
Blykloridegenskaper, struktur, bruksområder
De blyklorid er et uorganisk salt hvis kjemiske formel er PbCln, hvor n er oksidasjonsantallet av bly. Så når bly er +2 eller +4, er salt PbClto eller PbCl4, henholdsvis. Derfor er det to typer klorider for dette metallet.
Av de to, PbClto det er det viktigste og stabile; mens PbCl4 det er ustabilt og mindre nyttig. Den første er ionisk i naturen, der kationen Pbto+ genererer elektrostatiske interaksjoner med Cl-anionet- å bygge et krystallgitter; og den andre er kovalent, med Pb-Cl-bindinger som stammer fra bly og klortetraeder.

En annen forskjell mellom de to blykloridene er at PbClto Det er et fast stoff av hvite krystaller med form av nåler (øvre bilde); mens PbCl4 Det er en gulaktig olje som kan krystallisere seg ved -15 ° C. PbCl-inngangto det er mer estetisk enn PbCl4.
I tillegg til det som allerede er nevnt, PbClto den finnes i naturen som mineralet cotunite; mens PbCl4 nei, da det er utsatt for forfall. Selv om fra PbCl4 du kan få PbOto, av PbClto utlede et uendelig utvalg av organometalliske forbindelser.
Artikkelindeks
- 1 eiendommer
- 1,1-bly (II) klorid
- 1.2 Bly (IV) klorid
- 2 Struktur
- 2,1-bly (II) klorid
- 2.2 Molekyl i gassfase
- 3 Nomenklatur
- 4 bruksområder
- 5 Referanser
Eiendommer
Egenskapene til blyklorid er i det vesentlige avhengig av oksidasjonsantallet av bly; siden klor ikke endres, men måten det samhandler med bly på, gjør det. Derfor må begge forbindelsene adresseres separat; bly (II) klorid på den ene siden, og bly (IV) klorid på den andre siden.
-Bly (II) klorid
Molarmasse
278,10 g / mol.
Fysisk utseende
Hvite fargede krystaller med nålformer.
Tetthet
5,85 g / ml.
Smeltepunkt
501ºC.
Kokepunkt
950ºC.
Vannløselighet
10,8 g / l ved 20 ° C. Det er dårlig løselig og vannet må varmes opp slik at en betydelig mengde kan oppløses.
Brytningsindeks
2.199.
Bly (IV) klorid
Molarmasse
349,012 g / mol.
Fysisk utseende
Gulaktig oljeaktig væske.
Tetthet
3,2 g / ml.
Smeltepunkt
-15ºC.
Kokepunkt
50 ° C Ved høyere temperaturer nedbrytes det og frigjør gassformet klor:
PbCl4(s) => PbClto(s) + Clto(g)
Faktisk kan denne reaksjonen bli veldig eksplosiv, så PbCl lagres.4 i svovelsyre ved -80 ° C.
Struktur
-Bly (II) klorid
Først ble det nevnt at PbClto er en ionisk forbindelse, så den består av Pb-ionerto+ og Cl- som bygger en krystall der et Pb: Cl-forhold lik 1: 2 er etablert; det vil si at det er dobbelt så mange Cl-anioner- hvilke kationer Pbto+.
Resultatet er at ortorhombiske krystaller dannes hvis ioner kan representeres med en modell av kuler og stenger som på bildet nedenfor..

Denne strukturen tilsvarer også strukturen til cotunittmineralet. Selv om stolpene brukes til å indikere en retning av den ioniske bindingen, bør den ikke forveksles med en kovalent binding (eller i det minste rent kovalent).
I disse ortorombiske krystallene er Pbto+ (gråaktige kuler) har ni Cl- (grønne sfærer) som omgir ham, som om han var innelukket i et trekantet prisme. På grunn av kompleksiteten i strukturen og den lave ionetettheten til Pbto+, det er vanskelig for molekyler å oppløse krystallen; grunnen til at det er dårlig løselig i kaldt vann.
Gassfasemolekyl
Når verken krystall eller væske tåler høye temperaturer, begynner ionene å fordampe som PbCl-molekyler.to diskret; det vil si med Cl-Pb-Cl kovalente bindinger og en vinkel på 98º, som om det var en boomerang. Gassfasen sies så å bestå av disse PbCl-molekyleneto og ingen ioner som bæres av luftstrømmer.
Bly (IV) klorid
I mellomtiden har PbCl4 det er en kovalent forbindelse. Hvorfor? Fordi kationen Pb4+ den er mindre og har også en høyere ionisk ladetetthet enn Pbto+, som forårsaker en større polarisering av Cl-elektronskyen-. Resultatet er at i stedet for en ionisk interaksjon Pb4+Cl-, den kovalente bindingen Pb-Cl dannes.
Tatt i betraktning dette, er likheten mellom PbCl4 og for eksempel CCl4; begge forekommer som enkelt tetraedriske molekyler. Dermed blir det forklart hvorfor dette blykloridet er en gulaktig olje under normale forhold; Cl-atomer er dårlig relatert til hverandre og "glir" når to PbCl-molekyler4 de kommer.
Men når temperaturen synker og molekylene bremser, er sannsynligheten og effekten av øyeblikkelige dipoler (PbCl4 er apolar gitt sin symmetri); og deretter fryser oljen som gule sekskantede krystaller:
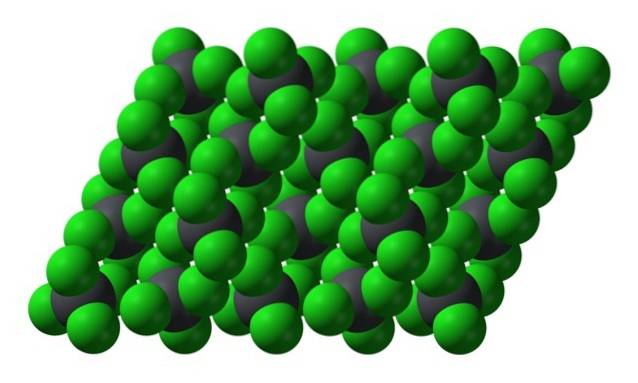
Merk at hver gråaktig kule er omgitt av fire grønne kuler. Disse PbCl-molekylene4 "Klemt sammen" utgjør en ustabil krystall som er utsatt for kraftig spaltning.
Nomenklatur
Navnene: bly (II) klorid og bly (IV) klorid tilsvarer de som er tildelt i henhold til lagernomenklaturen. Siden oksidasjonsnummeret +2 er det laveste for bly, og +4 det høyeste, kan begge klorider navngis i henhold til tradisjonell nomenklatur som plumboseklorid (PbClto) og blyklorid (PbCl4), henholdsvis.
Og til slutt er det den systematiske nomenklaturen, som fremhever antallet av hvert atom i forbindelsen. Dermed PbClto er blydiklorid og PbCl4 bly tetraklorid.
applikasjoner
Det er ingen kjent praktisk bruk for PbCl4 i tillegg til å tjene for syntesen av PbOto. Imidlertid PbClto Det er mer nyttig, og det er derfor bare noen bruksområder for dette spesifikke blykloridet vil bli oppført nedenfor:
- På grunn av sin meget selvlysende natur er den ment for fotografiske, akustiske, optiske og strålingsdetektorenheter.
- Siden den ikke absorberes i det infrarøde spekteret, brukes den til produksjon av briller som overfører denne typen stråling.
- Det har utgjort en del av det som kalles gyldent glass, et attraktivt materiale med iriserende blålig fargestoffer som brukes til dekorative formål..
- Fortsetter også med emnet teknikk, når alkalisert, PbCltoPb (OH)to Den får intense hvite toner og blir brukt som det hvite blypigmentet. Imidlertid er bruken avskrekket på grunn av høy giftighet..
- Smeltet og blandet med bariumtitanat, BaTiO3, stammer fra den keramiske blybariumtitanat Ba1 - xPbxOnkel3. Hvis en Pbto+ gå inn i BaTiO3, a Bato+ den må forlate krystallet for å tillate at den blir innlemmet, og en kationutveksling sies da å forekomme; derav sammensetningen av Bato+ er uttrykt som 1-x.
- Og til slutt, fra PbClto flere organometalliske blyforbindelser med den generelle formel R blir syntetisert4Pb eller R3Pb-PbR3.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Bly (II) klorid. Gjenopprettet fra: en.wikipedia.org
- Kjemisk formulering. (2019). Bly (IV) klorid. Gjenopprettet fra: formulacionquimica.com
- Clark Jim. (2015). Kloridene av karbon, silisium og bly. Gjenopprettet fra: chemguide.co.uk
- Spektrale og optiske ikke-lineære studier på blyklorid (PbClto) krystaller. [PDF]. Gjenopprettet fra: shodhganga.inflibnet.ac.in
- Nasjonalt senter for bioteknologisk informasjon. (2019). Blyklorid. PubChem-database; CID = 24459. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov



Ingen har kommentert denne artikkelen ennå.