
Tinn (II) oksidstruktur, egenskaper, nomenklatur, bruksområder

De tinn (II) oksid er et krystallinsk uorganisk fast stoff som dannes ved oksidasjon av tinn (Sn) av oksygen, der tinn får en 2+ valens. Den kjemiske formelen er SnO. To forskjellige former for denne forbindelsen er kjent: svart og rødt. Den vanligste og mest stabile formen ved romtemperatur er den svarte eller blå-svarte modifikasjonen..
Denne formen fremstilles ved hydrolyse av tinn (II) klorid (SnClto) i vandig oppløsning, til hvilken ammoniumhydroksyd (NH4OH) for å oppnå et hydratisert oksidutfelling av Sn (II) hvis formel er SnO.xHtoEller hvor x<1 (x menor que 1).
Det hydratiserte oksidet er et hvitt amorft fast stoff, som deretter oppvarmes i suspensjon ved 60-70 ° C i flere timer i nærvær av NH4OH, til du oppnår den rene, svarte, krystallinske SnO.
Den røde formen av SnO er metastabell. Den kan fremstilles ved å tilsette fosforsyre (H3PO4) - med 22% fosforsyre, H3PO3 - og deretter NH4OH til en SnCl-løsningto. Det oppnådde hvite faste stoffet oppvarmes i den samme løsningen ved 90-100 ° C i ca. 10 minutter. På denne måten oppnås det rene røde krystallinske SnO.
Tinn (II) oksyd er et utgangsmateriale for produksjon av andre tinn (II) forbindelser. Av denne grunn er det en av tinnforbindelsene som har betydelig kommersiell betydning..
Tinn (II) oksyd har lav toksisitet som forekommer med de fleste uorganiske tinnforbindelser. Dette skyldes dets dårlige absorpsjon og raske utskillelse fra vevene til levende vesener..
Den har en av de høyeste toleransene for tinnforbindelser i tester på rotter. Det kan imidlertid være skadelig ved innånding i store mengder..
Artikkelindeks
- 1 Struktur
- 1.1 Blå-svart tinn (II) oksid
- 1.2 Tinn (II) oksid rød
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Tetthet
- 3.5 Løselighet
- 3.6 Andre egenskaper
- 4 bruksområder
- 4.1 Ved produksjon av andre tinn (II) forbindelser
- 4.2 I smykker
- 4.3 Andre bruksområder
- 4.4 Nyere innovasjoner
- 5 Referanser
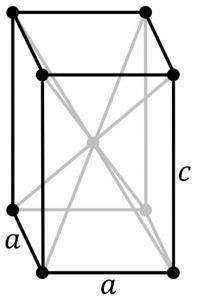
Struktur
Blå-svart tinn (II) oksid
Denne modifikasjonen krystalliserer med en tetragonal struktur. Den har et arrangement av lag der hvert Sn-atom er på toppen av en firkantet pyramide, hvis base er dannet av de 4 nærmeste oksygenatomer.
Andre forskere hevder at hvert Sn-atom er omgitt av 5 oksygenatomer som ligger omtrent i toppunktene til en oktaeder, hvor det sjette toppunktet antagelig er okkupert av et par frie eller uparede elektroner. Dette er kjent som Φ-oktaedrisk arrangement.
Tinn (II) oksid rød
Denne formen for tinn (II) oksyd krystalliserer med en ortorombisk struktur.
Nomenklatur
- Tinn (II) oksid
- Tannoksid
- Tinnmonoksid
- Tannoksid
Eiendommer
Fysisk tilstand
Krystallinsk fast stoff.
Molekylær vekt
134,71 g / mol.
Smeltepunkt
1080 ºC. Det nedbrytes.
Tetthet
6,45 g / cm3
Løselighet
Uoppløselig i varmt eller kaldt vann. Uoppløselig i metanol, men oppløses raskt i konsentrerte syrer og baser.
Andre egenskaper
Hvis det oppvarmes til mer enn 300 ºC i nærvær av luft, oksiderer tinn (II) oksid raskt til tinn (IV) oksid, og utgjør glødelampe.
Det er rapportert at under ikke-oksiderende forhold har oppvarmingen av tinn (II) oksyd forskjellige resultater avhengig av renhetsgraden til utgangsoksydet. Generelt uforholdsmessig til metallisk Sn og tinn (IV) oksid, SnOto, med forskjellige mellomarter som etter hvert blir SnOto.
Tinn (II) oksyd er amfotert, da det oppløses i syrer for å gi Sn-ionerto+ eller anionkomplekser, og oppløses også i baser for å danne løsninger av hydroksy-tinnate ioner, Sn (OH)3-, som har en pyramidestruktur.
I tillegg er SnO et reduksjonsmiddel og reagerer raskt med organiske syrer og mineralsyrer..
Den har lav toksisitet sammenlignet med andre tinnsalter. LD50 (50% dødelig dose eller median dødelig dose) hos rotter er mer enn 10.000 mg / kg. Dette betyr at det kreves mer enn 10 gram per kilo for å drepe 50% av rotteprøvene under en gitt testperiode. Til sammenligning har tinn (II) fluor en LD50 på 188 mg / kg hos rotter..
Imidlertid, hvis det inhaleres i lang tid, blir det avsatt i lungene fordi det ikke absorberes og kan forårsake stanose (infiltrasjon av SnO-støv i lungene)..
applikasjoner
Ved produksjon av andre tinn (II) forbindelser
Den raske reaksjonen med syrer er grunnlaget for den viktigste bruken, som er et mellomprodukt i fremstillingen av andre tinnforbindelser..
Den brukes i produksjonen av tinn (II) bromid (SnBrto), tinn (II) cyanid (Sn (CN)to) og tinn (II) fluorborathydrat (Sn (BF4)to), blant andre tinn (II) forbindelser.
Tinn (II) fluorborat fremstilles ved å oppløse SnO i fluorborinsyre og brukes til tinn- og tinn-blybelegg, spesielt ved avsetning av tinn-blylegeringer for lodding i elektronikkindustrien. Dette skyldes blant annet den høye dekningskapasiteten.
Tinn (II) oksyd brukes også til fremstilling av tinn (II) sulfat (SnSO)4), gjennom reaksjonen av SnO og svovelsyre, HtoSW4.
SnSO4 oppnådd brukes i fortinningsprosessen for produksjon av kretskort, for etterbehandling av elektriske kontakter og for tinning av kjøkkenutstyr.

Den hydratiserte formen av SnO, den hydratiserte tinn (II) oksydet SnO.xHtoEller den behandles med flussyre for å oppnå tinn (II) fluor, SnFto, som tilsettes tannkremer som et middel for å bekjempe hulrom.
I smykker
Tinn (II) oksid brukes til fremstilling av gull-tinn og kobber-tinn rubinkrystaller. Tilsynelatende er dens funksjon i denne applikasjonen å fungere som et reduksjonsmiddel.

Andre bruksområder
Den har blitt brukt i solcelleanordninger for produksjon av elektrisitet fra lys, for eksempel solceller.

Nylige innovasjoner
Arrangerte SnO-nanopartikler har blitt brukt i karbon-nanorørelektroder for litium-svovelbatterier.

SnO-forberedte elektroder har høy ledningsevne og liten volumendring i repeterende lade- og utladningssykluser.
I tillegg muliggjør SnO rask ion / elektronoverføring under oksidasjonsreduksjonsreaksjoner som oppstår i slike batterier..
Referanser
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Bailar, J.C.; Emeléus, H.J.; Sir Ronald Nyholm og Trotman-Dickenson, A.F. (1973). Omfattende uorganisk kjemi. Volum 2. Pergamon Press.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A27. VCH Verlagsgesellschaft mbH.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volum 24. Fjerde utgave. John Wiley & Sons.
- Ostrakhovitch, Elena A. og Cherian, M. George. (2007). Tinn. I håndbok for metoksikologi. Tredje utgave. Gjenopprettet fra sciencedirect.com.
- Kwestroo, W. og Vromans, P.H.G.M. (1967). Fremstilling av tre modifikasjoner av rent tinn (II) oksid. J. Inorg. Kjernen. Chem., 1967, bind 29, s. 2187-2190.
- Fouad, S.S et al. (1992). Optiske egenskaper til tynne oksydtynner. Czechoslovak Journal of Physics. Februar 1992, bind 42, utgave 2. Gjenopprettet fra springer.com.
- A-Young Kim et al. (2017). Bestilte SnO nanopartikler i MWCNT som et funksjonelt vertsmateriale for høyhastighets litium-svovel batterikatode. Nano Research 2017, 10 (6). Gjenopprettet fra springer.com.
- National Library of Medicine. (2019). Tannoksid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov


Ingen har kommentert denne artikkelen ennå.