
Kjemisk konsentrasjonsuttrykk, enheter, molalitet

De kjemisk konsentrasjon er det numeriske målet på den relative mengden løsemiddel i en løsning. Dette tiltaket uttrykker et forhold mellom det oppløste stoffet og en mengde eller volum av løsningsmidlet eller løsningen i konsentrasjonsenheter. Uttrykket "konsentrasjon" er relatert til mengden løsemiddel som er tilstede: en løsning vil være mer konsentrert jo mer løsemiddel den har.
Disse enhetene kan være fysiske når massen og / eller volumstørrelsen på løsningen eller kjemiske komponenter blir tatt i betraktning, når konsentrasjonen av det oppløste stoffet uttrykkes i form av mol eller ekvivalenter, og tar Avogadros nummer som referanse..

Ved å bruke molekylvekter eller atomvekter og Avogadros antall er det således mulig å konvertere fysiske enheter til kjemiske enheter når man uttrykker konsentrasjonen av en gitt løsemiddel. Derfor kan alle enheter konverteres til samme løsning.
Artikkelindeks
- 1 Fortynnede og konsentrerte løsninger
- 2 måter å uttrykke konsentrasjon på
- 2.1 Kvalitativ beskrivelse
- 2.2 Klassifisering etter løselighet
- 2.3 Kvantitativ notasjon
- 3 konsentrasjonsenheter
- 3.1 Relative konsentrasjonsenheter
- 3.2 Enheter med fortynnet konsentrasjon
- 3.3 Enheter av konsentrasjon som en funksjon av mol
- 3.4 Formalitet og normalitet
- 4 Molaritet
- 4.1 Øvelse 1
- 4.2 Øvelse 2
- 5 Normalitet
- 5.1 Beregning
- 5.2 Øvelse 1
- 6 Molalitet
- 6.1 Øvelse 1
- 7 Viktige merknader og anbefalinger om kjemisk konsentrasjon
- 7.1 Volumet av løsningen er alltid større enn løsningsmidlets volum
- 7.2 Utnyttelse av molaritet
- 7.3 Formler blir ikke husket, men enheter eller definisjoner
- 8 Referanser
Fortynnede og konsentrerte løsninger
Hvordan kan du se om en konsentrasjon er veldig fortynnet eller konsentrert? Ved første øyekast ved manifestasjonen av noen av dets organoleptiske eller kjemiske egenskaper; det vil si de som sansene oppfatter eller som kan måles.
Bildet over viser en fortynning av en konsentrasjon av kaliumdikromat (KtoCrtoELLER7), som har en oransje farge. Fra venstre til høyre kan du se hvordan fargen reduserer intensiteten når konsentrasjonen fortynnes, og tilfører mer løsemiddel.
Denne fortynningen gjør det mulig å oppnå en fortynnet konsentrasjon fra en konsentrert på denne måten. Fargen (og andre "skjulte" egenskaper i sin oransje kjerne) endres på samme måte som konsentrasjonen gjør, enten med fysiske eller kjemiske enheter..
Men hva er de kjemiske enhetene for konsentrasjon? Blant dem er molariteten eller molar konsentrasjonen av en løsning, som relaterer mol oppløst stoff med det totale volumet av løsningen i liter.
Det er også molalitet eller også kalt molal konsentrasjon, som refererer til mol oppløst stoff, men som er inneholdt i en standardisert mengde av løsningsmidlet eller løsningsmidlet som er nøyaktig ett kilo.
Dette løsningsmidlet kan være rent, eller hvis løsningen inneholder mer enn ett løsningsmiddel, vil molaliteten være mol oppløst stoff per kg løsningsmiddelblanding..
Og den tredje enheten av kjemisk konsentrasjon er normaliteten eller den normale konsentrasjonen av en løsning som uttrykker antall kjemiske ekvivalenter av det oppløste stoffet per liter oppløsningen.
Enheten der normalitet uttrykkes er i ekvivalenter per liter (Eq / L) og i medisin uttrykkes konsentrasjonen av elektrolytter i humant serum i milliekvivalenter per liter (mEq / L).
Måter å uttrykke konsentrasjon på

Konsentrasjonen av en løsning kan betegnes på tre hovedveier, selv om de har et stort utvalg av termer og enheter selv, som kan brukes til å uttrykke mål på denne verdien: kvalitativ beskrivelse, kvantitativ notasjon og klassifisering i termer av løselighet.
Avhengig av språket og konteksten du jobber med, vil en av de tre måtene bli valgt for å uttrykke konsentrasjonen av en blanding.
Kvalitativ beskrivelse
Brukes hovedsakelig på uformelt og ikke-teknisk språk, den kvalitative beskrivelsen av konsentrasjonen av en blanding uttrykkes i form av adjektiver, som på en generalisert måte indikerer konsentrasjonsnivået som en løsning har.
På denne måten er minimumskonsentrasjonsnivået i henhold til den kvalitative beskrivelsen det som er en "fortynnet" løsning, og det maksimale er det som er "konsentrert"..
Vi snakker om fortynnede løsninger når en løsning har en veldig lav andel løselig som en funksjon av det totale volumet av løsningen. Hvis du vil fortynne en løsning, må du tilsette mer løsemiddel eller finne en måte å redusere løsemidlet på.
Nå snakker vi om konsentrerte løsninger når de har en høy andel løst stoff som en funksjon av det totale løsningsvolumet. For å konsentrere en løsning må du tilsette mer løsemiddel, eller redusere mengden løsemiddel.
I denne forstand kalles denne klassifiseringen en kvalitativ beskrivelse, ikke bare fordi den mangler matematiske målinger, men også på grunn av dens empiriske kvalitet (den kan tilskrives visuelle egenskaper, lukt og smak, uten behov for vitenskapelige tester)..
Klassifisering etter løselighet
Løseligheten til en konsentrasjon angir den maksimale oppløselighetskapasiteten som en løsning har, avhengig av forhold som temperatur, trykk og stoffene som er oppløst eller i suspensjon..
Løsninger kan klassifiseres i tre typer i henhold til nivået av oppløst løsemiddel på måletidspunktet: umettede, mettede og overmettede løsninger.
- Umettede løsninger er de som inneholder mindre løsemiddel enn løsningen kan oppløses. I dette tilfellet har løsningen ikke nådd sin maksimale konsentrasjon.
- Mettede oppløsninger er de hvor den maksimale mengden mulig oppløst er oppløst i løsningsmidlet ved en spesifikk temperatur. I dette tilfellet er det en likevekt mellom begge stoffene, og løsningen kan ikke akseptere mer oppløst stoff (siden det vil presipitere).
- Overmettede løsninger har mer løsemiddel enn løsningen ville akseptere under likevektsforhold. Dette oppnås ved å varme opp en mettet løsning og tilsette mer løsemiddel enn normalt. Når det er kaldt, vil det ikke utløse det oppløste stoffet automatisk, men forstyrrelser kan forårsake denne effekten på grunn av ustabilitet..
Kvantitativ notasjon
Når man studerer en løsning som skal brukes innen det tekniske eller vitenskapelige feltet, kreves en nøyaktighet målt og uttrykt i enheter, som beskriver konsentrasjonen i henhold til dens eksakte masse- og / eller volumverdier..
Dette er grunnen til at det er en serie enheter som brukes til å uttrykke konsentrasjonen av en løsning i dens kvantitative notasjon, som er delt inn i fysiske og kjemiske, og som igjen har sine egne underavdelinger.
Enhetene med fysiske konsentrasjoner er de med "relativ konsentrasjon", som uttrykkes i prosent. Det er tre måter å uttrykke prosentkonsentrasjoner: masseprosenter, volumprosenter og massevolumprosent..
I stedet er enheter av kjemiske konsentrasjoner basert på molære mengder, gramekvivalenter, deler per million og andre egenskaper av løsemidlet i forhold til løsningen..
Disse enhetene er de vanligste på grunn av deres høye presisjon når de måler konsentrasjoner, og av den grunn er de vanligvis de du vil vite om å jobbe med kjemiske løsninger..
Konsentrasjonsenheter
Som beskrevet i de foregående avsnittene, må beregningene styres av de eksisterende enhetene for dette formålet når de kvantitativt karakteriserer konsentrasjonen av en løsning..
På samme måte er konsentrasjonsenhetene delt inn i de med relativ konsentrasjon, de med fortynnede konsentrasjoner, de som er basert på mol, og andre ytterligere..
Relative konsentrasjonsenheter
Relative konsentrasjoner er de som er uttrykt i prosent, som nevnt i forrige avsnitt. Disse enhetene er delt inn i massemasseprosent, volumvolumprosent og massevolumprosent, og beregnes som følger:
- % masse = masse av oppløst stoff (g) / masse av total løsning (g) x 100
- % volum = volum oppløst stoff (ml) / volum totaloppløsning (ml) x 100
- % masse / volum = masse oppløst stoff (g) / volum totaloppløsning (ml) x 100
I dette tilfellet, for å beregne massen eller volumet av den totale løsningen, må massen eller volumet av det oppløste stoffet tilsettes sammen med løsemidlet..
Enheter med fortynnet konsentrasjon
De fortynnede konsentrasjonsenhetene er de som brukes til å uttrykke de veldig små konsentrasjonene som finnes i form av spor i en fortynnet løsning. den vanligste bruken for disse enhetene er å finne spor av en gass oppløst i en annen, for eksempel stoffer som forurenser luften.
Disse enhetene er indikert i form av deler per million (ppm), deler per milliard (ppb) og deler per billion (ppt), og uttrykkes som følger:
- ppm = 1 mg oppløst stoff / 1 L oppløsning
- ppb = 1 μg oppløsningsmiddel / 1 L løsning
- ppt = 1 ng oppløsningsmiddel / 1 L løsning
I disse uttrykkene er mg lik milligram (0,001 g), μg tilsvarer mikrogram (0,000001 g), og ng tilsvarer nanogram (0,000000001 g). Disse enhetene kan også uttrykkes som en funksjon av volum / volum.
Konsentrasjonsenheter som en funksjon av mol
Konsentrasjonsenhetene basert på mol er de av molfraksjonen, molprosenten, molariteten og molaliteten (de to sistnevnte er bedre beskrevet på slutten av artikkelen).
Molfraksjonen til et stoff er fraksjonen av alle dets bestanddeler molekyler (eller atomer) som en funksjon av de totale molekyler eller atomer. Det beregnes som følger:
XTIL = antall mol stoff A / totalt antall mol i oppløsning
Denne prosedyren gjentas for de andre stoffene i oppløsning, idet det tas hensyn til at summen av XTIL + XB + XC ... må være lik en.
Molprosenten er bearbeidet på en lignende måte som XTIL, bare i prosent:
Molprosent av A = XTIL x 100%
Den siste delen vil diskutere molaritet og molalitet i detalj..
Formalitet og normalitet
Til slutt er det to enheter av konsentrasjon som for tiden er i bruk: formalitet og normalitet..
Formaliteten til en løsning representerer antall vekt-formel-gram per liter total løsning. Det uttrykkes som:
F = Nei. P.F.G / L-løsning
I dette uttrykket er P.F.G lik vekten av hvert atom av stoffet, uttrykt i gram.
I stedet representerer normaliteten antall oppløste ekvivalenter delt på liter oppløsning, som uttrykt nedenfor:
N = ekvivalent gram løst / L oppløsning
I dette uttrykket kan ekvivalente gram oppløst stoff beregnes med antall mol H+, Åh- eller andre metoder, avhengig av typen molekyl.
Molaritet
Molariteten eller molar konsentrasjonen av et oppløst stoff er enheten av kjemisk konsentrasjon som uttrykker eller relaterer molene av det oppløste stoffet (n) som er inneholdt i en (1) liter (L) av løsningen.
Molaritet betegnes med store bokstaver M, og for å bestemme molene av det oppløste stoffet (n), deles gramene av det oppløste stoffet (g) med molekylvekten (MW) av det oppløste stoffet..
Likeledes er molekylvekten MW av det oppløste stoffet oppnådd fra summen av atomvektene (PA) eller atommassen til de kjemiske elementene, med tanke på andelen de kombinerer for å danne det oppløste stoffet. Dermed har forskjellige oppløste stoffer sin egen PM (selv om dette ikke alltid er tilfelle).
Disse definisjonene er oppsummert i følgende formler som brukes til å utføre tilsvarende beregninger:
Molaritet: M = n (mol oppløst stoff) / V (liter løsning)
Antall mol: n = g oppløst stoff / MW oppløst stoff
Øvelse 1
Beregn molariteten til en løsning som er tilberedt med 45 g Ca (OH)to oppløst i 250 ml vann.
Den første tingen å beregne er molekylvekten til Ca (OH)to (kalsiumhydroksid). Ifølge den kjemiske formelen består forbindelsen av et kalsiumkation og to hydroksylanioner. Her er vekten av et elektron som er mindre eller tillegg til arten ubetydelig, så atomvektene tas:
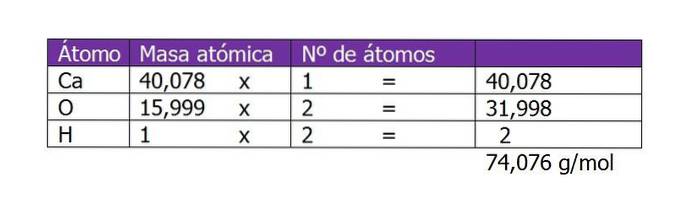
Antall mol av det oppløste stoffet vil da være:
n = 45 g / (74 g / mol)
n = 0,61 mol Ca (OH)to
Det oppnås 0,61 mol av det oppløste stoffet, men det er viktig å huske at disse molene ligger oppløst i 250 ml løsning. Siden definisjonen av molaritet er mol i a liter eller 1000 ml, må det deretter lages en enkel regel på tre for å beregne føflekker som er i 1000 ml av nevnte løsning
Hvis det er 250 ml oppløsning, er det => 0,61 mol oppløst stoff
I 1000 ml løsning => x Hvor mange føflekker er det?
x = (0,61 mol) (1000 ml) / 250 ml
X = 2,44 M (mol / L)
Annen vei
Den andre måten å skaffe føflekker for å bruke formelen krever at 250 ml tas til liter, og bruker også en regel på tre:
Hvis 1000 ml => er 1 liter
250 ml => x Hvor mange liter er?
x = (250 ml) (1 liter) / 1000 ml
x = 0,25 l
Erstatter deretter i Molarity-formelen:
M = (0,61 mol oppløst stoff) / (0,25 L oppløsning)
M = 2,44 mol / l
Øvelse 2
Hva betyr det at en HCl-løsning er 2,5 M?
HCl-løsningen er 2,5 molar, det vil si at en liter av den har oppløst 2,5 mol saltsyre..
Vanlig
Normaliteten eller ekvivalent konsentrasjon, er enheten for kjemisk konsentrasjon av løsningene som er betegnet med store bokstaver N. Denne konsentrasjonsenheten indikerer reaktiviteten til det oppløste stoffet og er lik antall ekvivalenter oppløst stoff (Eq) mellom oppløsningsvolumet uttrykt i liter.
N = Eq / L
Antall ekvivalenter (Eq) er lik gram oppløst stoff delt på ekvivalent vekt (PEq).
Eq = g løsemiddel / PEq
Den ekvivalente vekten, eller også kjent som gramekvivalent, beregnes ved å oppnå molekylvekten til det oppløste stoffet og dele den med en ekvivalent faktor som for å oppsummere i ligningen kalles delta zeta (ΔZ).
PEq = PM / AZ
Beregning
Beregningen av normalitet vil ha en veldig spesifikk variasjon i den ekvivalente faktoren eller AZ, som også avhenger av hvilken type kjemisk reaksjon den oppløste eller reaktive arten deltar i. Noen tilfeller av denne variasjonen kan nevnes nedenfor:
-Når det gjelder en syre eller base, vil AZ eller ekvivalent faktor være lik antall hydrogenioner (H+) eller hydroksyl OH- som har løsningen. For eksempel svovelsyre (HtoSW4) har to ekvivalenter fordi den har to sure protoner.
-Når det gjelder oksidasjonsreduksjonsreaksjoner, vil AZ svare til antall elektroner som er involvert i oksidasjons- eller reduksjonsprosessen, avhengig av det spesifikke tilfellet. Det er her balanseringen av kjemiske ligninger og spesifikasjonen av reaksjonen spiller inn..
-På samme måte vil denne ekvivalente faktoren eller ΔZ tilsvare antall ioner som utfelles i reaksjoner klassifisert som nedbør..
Øvelse 1
Bestem normaliteten til 185 g NatoSW4 funnet i 1,3 liter løsning.
Molekylvekten til det oppløste stoffet i denne løsningen beregnes først:
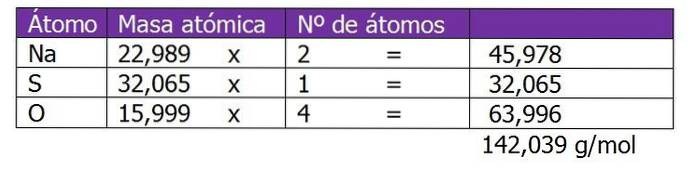
Det andre trinnet er å beregne ekvivalent faktor eller ΔZ. I dette tilfellet, siden natriumsulfat er et salt, vil valensen eller ladningen av kationen eller metallet Na bli vurdert.+, som vil bli multiplisert med 2, som er tegnet på den kjemiske formelen salt eller oppløst stoff:
NatoSW4 => ∆Z = Valencia Kation x Abonnement
∆Z = 1 x 2
For å oppnå tilsvarende vekt erstattes den i sin respektive ligning:
PEq = (142,039 g / mol) / (2 Eq / mol)
PEq = 71,02 g / Eq
Og så kan du fortsette å beregne antall ekvivalenter, igjen å ty til en annen enkel beregning:
Eq = (185 g) / (71,02 g / Eq)
Antall ekvivalenter = 2.605 Ekv
Til slutt, med alle nødvendige data, beregnes normaliteten nå ved å erstatte i henhold til definisjonen:
N = 2,605 Eq / 1,3 L
N = 2,0 N
Molalitet
Molalitet betegnes med små bokstaver m y er lik mol oppløst stoff som er til stede i ett (1) kg løsningsmiddel. Det er også kjent som molal konsentrasjon og beregnes ved hjelp av følgende formel:
m = mol oppløst stoff / kg løsningsmiddel
Mens molaritet fastslår forholdet mellom mol oppløst stoff som finnes i en (1) liter av løsningen, er molaliteten relatert til mol oppløst stoff som finnes i ett (1) kg løsningsmiddel.
I de tilfeller løsningen blir fremstilt med mer enn ett løsningsmiddel, vil molaliteten uttrykke de samme mol oppløst stoff per kg løsningsmiddelblanding..
Øvelse 1
Bestem molaliteten til en løsning som ble fremstilt ved å blande 150 g sukrose (C12H220elleve) med 300 g vann.
Molekylvekten til sukrose bestemmes først for å fortsette å beregne mol oppløst stoff i denne løsningen:
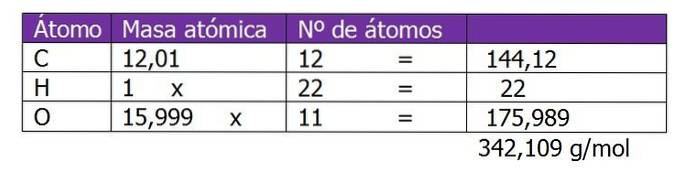
Antall mol sukrose beregnes:
n = (150 g sukrose) / (342,109 g / mol)
n = 0,438 mol sukrose
Deretter blir gram løsningsmiddel tatt til kilo for å kunne bruke den endelige formelen.
Erstatter da:
m = 0,438 mol sukrose / 0,3 kg vann
m = 1,46 mol C12H220elleve/ Kg HtoELLER
Selv om det for tiden er en debatt om det endelige uttrykket for molalitet, kan dette resultatet også uttrykkes som:
1,26 m C12H220elleve eller 1,26 molal
Noen ganger blir det ansett som fordelaktig å uttrykke konsentrasjonen av løsningen i form av molalitet, siden massene av det oppløste stoffet og løsningsmidlet ikke lider av små svingninger eller uforutsette endringer på grunn av effekten av temperatur eller trykk; slik det skjer i løsninger med gassformig løsemiddel.
I tillegg blir det påpekt at denne konsentrasjonsenheten referert til en spesifikk løsemiddel er uendret av eksistensen av andre oppløste stoffer i løsningen..
Anbefalinger og viktige merknader om kjemisk konsentrasjon
Volumet av løsningen er alltid større enn løsningsmidlets volum
Når løsningsøvelsene er løst, oppstår feilen ved å tolke volumet av en løsning som om det var løsningsmidlet. For eksempel, hvis et gram pulverisert sjokolade er oppløst i en liter vann, er volumet av løsningen ikke lik volumet av en liter vann..
Hvorfor ikke? Fordi løsemiddelet alltid vil oppta mellomrom mellom løsemiddelmolekylene. Når løsningsmidlet har høy affinitet for løsemidlet, kan volumendringen etter oppløsning være ubetydelig eller ubetydelig..
Men hvis ikke, og enda mer hvis mengden løsemiddel er stor, må volumendringen tas i betraktning. Å være på denne måten: Vsolvent + Vsolute = Vsolution. Bare i fortynnede oppløsninger eller hvor mengden oppløst stoff er liten, er gyldig Vsolvent = Vsolution.
Denne feilen må man huske på spesielt når man arbeider med flytende oppløste stoffer. For eksempel, hvis honning er oppløst i alkohol i stedet for å oppløse pulverisert sjokolade, vil volumet av tilsatt honning ha betydelige effekter på det totale volumet av løsningen..
Derfor må volumet av det oppløste stoffet tilsettes til løsningsmidlet..
Utnyttelse av molaritet
-Å kjenne molariteten til en konsentrert løsning gjør at fortynningsberegninger kan utføres ved hjelp av den enkle formelen M1V1 = M2V2, der M1 tilsvarer den opprinnelige molariteten til løsningen og M2 molariteten til løsningen som skal fremstilles fra løsningen M1.
-Å kjenne molariteten til en løsning, kan dens normalitet enkelt beregnes ved hjelp av følgende formel: Normalitet = antall ekvivalenter x M
Formlene blir ikke husket, men enhetene eller definisjonene er
Noen ganger husker imidlertid ikke minnet alle ligningene som er relevante for konsentrasjonsberegninger. For dette er det veldig nyttig å ha en veldig klar definisjon av hvert konsept.
Fra definisjonen er enhetene skrevet ved hjelp av konverteringsfaktorer å uttrykke de som tilsvarer det du vil bestemme.
For eksempel, hvis du har molalitet og vil konvertere den til normal, gjør du slik:
(mol / Kg løsemiddel) x (kg / 1000 g) (g løsemiddel / ml) (ml løsemiddel / ml løsning) (1000 ml / L) (Eq / mol)
Merk at (g løsningsmiddel / ml) er tettheten til løsningsmidlet. Begrepet (ml løsningsmiddel / ml løsning) refererer til hvor mye volum av løsningen som faktisk tilsvarer løsningsmidlet. I mange øvelser er denne siste terminen lik 1, av praktiske årsaker, selv om den aldri er helt sant..
Referanser
- Innledende kjemi - 1St. Kanadisk utgave. Kvantitative enheter av konsentrasjon. Kapittel 11 Løsninger. Hentet fra: opentextbc.ca
- Wikipedia. (2018). Tilsvarende konsentrasjon. Hentet fra: en.wikipedia.org
- PharmaFactz. (2018). Hva er molaritet? Hentet fra: pharmafactz.com
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Learning, s 101-103, 512, 513.
- Vandige løsninger-molaritet. Hentet fra: chem.ucla.edu
- Quimicas.net (2018). Eksempler på normalitet. Gjenopprettet fra: quimicas.net.



Ingen har kommentert denne artikkelen ennå.