
Kromegenskaper, egenskaper og bruksområder

De krom (Cr) er et metallisk element i gruppe 6 (VIB) i det periodiske systemet. Tonn av dette metallet produseres årlig gjennom ekstraksjon fra mineralet kromjern eller magnesium (FeCrtoELLER4, MgCrtoELLER4), som reduseres med karbon for å oppnå metallet. Det er veldig reaktivt, og bare under veldig reduserende forhold finnes det i sin rene form.
Navnet stammer fra det greske ordet 'chroma', som betyr farge. Det ble gitt dette navnet på grunn av flere og intense farger utstilt av kromforbindelser, enten uorganiske eller organiske; fra svarte faste stoffer eller løsninger til gul, oransje, grønn, lilla, blå og rød.

Imidlertid er fargen på metallisk krom og karbider sølvgrå. Denne egenskapen blir utnyttet i forkromingsteknikken for å gi mange strukturer sølvglitter (som de som er sett i krokodillen på bildet ovenfor). Ved å "bade med krom" får stykkene således glans og stor motstand mot korrosjon..
Krom i løsning reagerer raskt med oksygen i luften og danner oksider. Avhengig av pH og oksidasjonsbetingelser for mediet, kan det tilegne seg forskjellige oksidasjonstall, idet de er (III) (Cr3+) den mest stabile av alle. Følgelig krom (III) oksid (CrtoELLER3) grønn farge er den mest stabile av oksidene.
Disse oksidene kan samhandle med andre metaller i miljøet og forårsake for eksempel pigmentet Siberian red lead (PbCrO4). Dette pigmentet er gul-oransje eller rødt (i henhold til alkaliniteten), og fra det isolerte den franske forskeren Louis Nicolas Vauquelin metallisk kobber, og det er derfor han blir tildelt som oppdageren.
Dens mineraler og oksider, samt en liten del av metallisk kobber, gjør at dette elementet opptar nummer 22 av de mest vanlige i jordskorpen..
Kromens kjemi er veldig mangfoldig fordi den kan danne bindinger med nesten hele det periodiske systemet. Hver av forbindelsene har farger som avhenger av oksidasjonsnummeret, så vel som artene som samhandler med det. På samme måte danner det bindinger med karbon, og griper inn i et stort antall organometalliske forbindelser..
[TOC]
Kjennetegn og egenskaper
Krom er et sølvfarget metall i sin rene form, med et atomnummer på 24 og en molekylvekt på omtrent 52 g / mol (52Cr, dens mest stabile isotop).
Gitt sine sterke metallbindinger, har den høye smeltepunkter (1907 ° C) og kokepunkter (2671 ° C). Dessuten gjør den krystallinske strukturen det til et veldig tett metall (7,19 g / ml).
Det reagerer ikke med vann for å danne hydroksider, men det reagerer med syrer. Det oksyderer med oksygenet i luften, og produserer vanligvis kromoksid, som er et mye brukt grønt pigment..
Disse oksydlagene skaper det som er kjent som passivasjon, beskytter metallet mot påfølgende korrosjon, siden oksygen ikke kan trenge gjennom metall sinus.
Elektronkonfigurasjonen er [Ar] 4s13d5, med alle elektroner uparret, og har derfor paramagnetiske egenskaper. Imidlertid kan sammenkoblingen av elektroniske spinn oppstå hvis metallet utsettes for lave temperaturer, og tilegner seg andre egenskaper som antiferromagnetisme..
Artikkelindeks
- 1 Egenskaper og egenskaper
- 2 Kjemisk struktur av krom
- 3 oksidasjonsnummer
- 3.1 Cr (-2, -1 og 0)
- 3.2 Cr (I) og Cr (II)
- 3,3 Cr (III)
- 3,4 Cr (IV) og Cr (V)
- 3,5 Cr (VI): kromat-dikromatparet
- 4 Bruk av krom
- 4.1 Som fargestoff eller pigmenter
- 4.2 I forkromning eller metallurgi
- 4.3 Ernæringsmessige
- 5 Hvor er?
- 6 Referanser
Krom kjemisk struktur
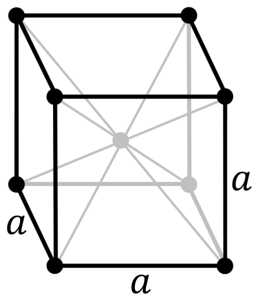
Hva er strukturen til krommetall? I sin rene form antar krom en kroppssentrert kubisk (cc eller bcc) krystallstruktur. Dette betyr at kromatomet er plassert i midten av en kube, hvis kanter er okkupert av andre kromer (som på bildet ovenfor).
Denne strukturen er ansvarlig for at krom har høye smelte- og kokepunkter, samt stor hardhet. Kobberatomer overlapper s- og d-orbitaler for å danne ledningsbånd i henhold til båndteori.
Dermed er begge bandene halvfullt. Hvorfor? Fordi elektronkonfigurasjonen er [Ar] 4s13d5 og som s orbital kan huse to elektroner, og d-orbitalene ti. Så er bare halvparten av båndene dannet av deres overlappinger okkupert av elektroner..
Med disse to perspektivene - den krystallinske strukturen og metallbindingen - kan mange av de fysiske egenskapene til dette metallet forklares i teorien. Ingen av dem forklarer imidlertid hvorfor krom kan ha forskjellige oksidasjonstilstander eller tall..
Dette vil kreve en dyp forståelse av atomets stabilitet med hensyn til elektroniske spinn..
Oksidasjonsnummer
Fordi elektronkonfigurasjonen til krom er [Ar] 4s13d5 kan få opptil en eller to elektroner (Cr1- og CRto-), eller miste dem for å skaffe seg forskjellige oksidasjonsnumre.
Således, hvis krom mister et elektron, vil det forbli som [Ar] 4s03d5; hvis han mister tre, [Ar] 4s03d3; og hvis det mister dem alle, [Ar], eller hva som er likt, ville det være isoelektronisk å argonere.
Krom mister ikke eller får ikke elektroner ved bare innfall: det må være en art som donerer eller aksepterer dem for å gå fra ett oksidasjonsnummer til et annet.
Krom har følgende oksidasjonsnumre: -2, -1, 0, +1, +2, +3, +4, +5 og +6. Av dem +3, Cr3+, den er den mest stabile og derfor dominerende av alle; etterfulgt av +6, Cr6+.
Cr (-2, -1 og 0)
Det er svært lite sannsynlig at krom får elektroner, siden det er et metall, og derfor er dets natur å donere dem. Imidlertid kan den koordinere seg med ligander, det vil si molekyler som samhandler med metallsenteret gjennom en dativbinding..
En av de mest kjente er karbonmonoksid (CO), som danner heksakarbonylforbindelsen av krom.
Denne forbindelsen har molekylformelen Cr (CO)6, og siden ligandene er nøytrale og ikke gir noen ladning, har Cr et oksidasjonsnummer på 0.
Dette kan også observeres i andre organometalliske forbindelser som bis (benzen) krom. I sistnevnte er krom omgitt av to benzenringer i en molekylær struktur av sandwich-typen:
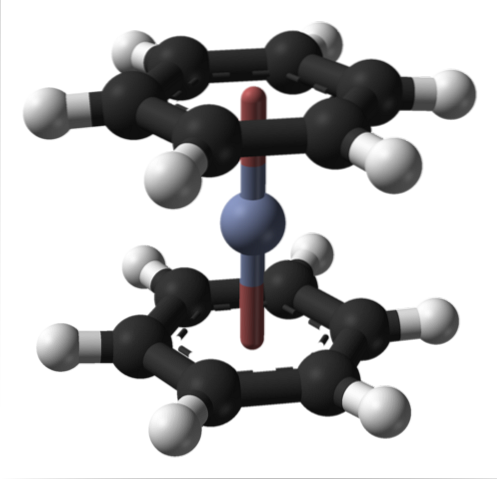
Fra disse to organometalliske forbindelsene kan mange andre oppstå fra Cr (0).
Salter er funnet der de samhandler med natriumkationer, noe som innebærer at Cr må ha et negativt oksidasjonsnummer for å tiltrekke seg positive ladninger: Cr (-2), Nato[Cr (CO)5] og Cr (-1), Nato[Crto(CO)10].
Cr (I) og Cr (II)
Cr (I) eller Cr1+ Den er produsert ved oksydasjon av de nettopp beskrevne organometalliske forbindelser. Dette oppnås ved oksiderende ligander, slik som CN eller NO, og danner for eksempel forbindelse K3[Cr (CN)5IKKE].
Her er det faktum at du har tre K-kationer+ Det antyder at kromkomplekset har tre negative ladninger; også liganden CN- bidrar med fem negative ladninger, slik at mellom Cr og NO må legge til to positive ladninger (-5 + 2 = -3).
Hvis NO er nøytral, er det Cr (II), men hvis den har en positiv ladning (NO+), er i så fall Cr (I).
På den annen side er Cr (II) forbindelser rikere, inkludert følgende: krom (II) klorid (CrClto), kromacetat (Crto(ELLERtoCCH3)4), krom (II) oksid (CrO), krom (II) sulfid (CrS) og mer.
Cr (III)
Av alt er det den som har størst stabilitet, siden den faktisk er et produkt av mange oksidative reaksjoner av kromationer. Kanskje skyldes stabiliteten den elektroniske konfigurasjonen d3, der tre elektroner opptar tre orbitaler med lavere energi sammenlignet med de andre to mer energiske (splitting av d-orbitaler).
Den mest representative forbindelsen til dette oksidasjonsnummeret er krom (III) oksid (CrtoELLER3). Avhengig av ligander som koordinerer seg til det, vil komplekset oppvise en eller annen farge. Eksempler på disse forbindelsene er: [CrClto(HtoELLER)4] Cl, Cr (OH)3, CrF3, [Cr (HtoELLER)6]3+, etc.
Selv om den kjemiske formelen ikke viser det ved første øyekast, har krom vanligvis en oktaedrisk koordinasjonssfære i sine komplekser; det vil si at den ligger i sentrum av en oktaeder hvor toppunktene er plassert av ligandene (totalt seks).
Cr (IV) og Cr (V)
Forbindelsene som Cr deltar i5+ er svært få på grunn av den elektroniske ustabiliteten til nevnte atom, i tillegg til at de lett blir oksidert til Cr6+, mye mer stabil da den er isoelektronisk sammenlignet med argongodsgass.
Imidlertid kan Cr (V) -forbindelser syntetiseres under visse betingelser, for eksempel høyt trykk. På samme måte har de en tendens til å brytes ned ved moderate temperaturer, noe som gjør deres mulige applikasjoner umulige ettersom de ikke har termisk motstand. Noen av dem er: CrF5 og K3[Cr (Oto)4] (Ototo- er peroksidanionet).
På den annen side er Cr4+ det er relativt mer stabilt og kan syntetisere halogenerte forbindelser: CrF4, CrCl4 og CrBr4. Imidlertid er de også utsatt for å bli spaltet av redoksreaksjoner for å produsere kromatomer med bedre oksidasjonstall (som +3 eller +6)..
Cr (VI): kromat-dikromatparet
2 [CrO4]to- + 2H+ (Gul) => [CrtoELLER7]to- + HtoO (oransje)
Ovennevnte ligning tilsvarer syredimeriseringen av to kromationer for å produsere dikromat. Variasjonen i pH forårsaker en endring i interaksjonene rundt metallsenteret til Cr6+, også tydelig i fargen på løsningen (fra gul til oransje eller omvendt). Dichromate består av en O-bro3Cr-O-CrO3.
Cr (VI) forbindelser har egenskapene til å være skadelige og til og med kreftfremkallende for menneskekroppen og dyrene.
Hvordan? Studier hevder at CrO-ioner4to- krysse cellemembraner ved virkningen av sulfattransporterende proteiner (begge ionene er faktisk like i størrelse).
Reduksjonsmidler i celler reduserer Cr (VI) til Cr (III), som akkumuleres ved å irreversibelt koordinere til spesifikke steder på makromolekyler (for eksempel DNA).
Forurenset cellen med et overskudd av krom, kan den ikke gå på grunn av mangel på mekanisme som transporterer den tilbake gjennom membranene.
Krom bruker
Som fargestoff eller pigmenter
Krom har et bredt spekter av applikasjoner, fra fargestoff for forskjellige typer stoffer, til beskytter som pynter metalldeler i det som er kjent som forkroming, som kan lages med rent metall, eller med Cr (III) forbindelser eller Cr (VI).
Kromfluorid (CrF3) brukes for eksempel som fargestoff for ullkluter; kromsulfat (Crto(SW4)3), den brukes til å fargelegge emaljer, keramikk, maling, blekk, lakk, og den brukes også til krommetaller; og kromoksid (CrtoELLER3) finner også bruk der den attraktive grønne fargen er nødvendig.
Derfor kan ethvert krommineral med intense farger være skjebnebestemt til å flekker en struktur, men etter det oppstår faktum om disse forbindelsene er farlige eller ikke for miljøet eller for helsen til individer.
Faktisk brukes dets giftige egenskaper for å bevare tre og andre overflater mot insektangrep..
I krom eller metallurgi
Små mengder krom tilsettes også stålet for å styrke det mot oksidasjon og for å forbedre glansen. Dette er fordi den er i stand til å danne gråaktige karbider (Cr3Cto) veldig motstandsdyktig mot å reagere med oksygen i luften.
Fordi krom kan poleres til blanke overflater, har krom sølvdesign og farger som et billigere alternativ for disse formålene..
Ernæringsmessig
Noen diskuterer om krom kan betraktes som et essensielt element, det vil si uunnværlig i det daglige kostholdet. Det er tilstede i noen matvarer i svært små konsentrasjoner, for eksempel grønne blader og tomater..
På samme måte er det proteintilskudd som regulerer insulinaktivitet og fremmer muskelvekst, som det er tilfelle med krompolynikotinat.
Hvor befinner det seg?

Krom finnes i et bredt utvalg av mineraler og edelstener som rubiner og smaragder. Hovedmineralet som krom utvinnes fra, er kromitt (MCrtoELLER4), hvor M kan være hvilket som helst annet metall som kromoksid er assosiert med. Disse gruvene florerer i Sør-Afrika, India, Tyrkia, Finland, Brasil og andre land.
Hver kilde har en eller flere kromvarianter. På denne måten oppstår for hvert M (Fe, Mg, Mn, Zn, etc.) et annet krommineral.
For å ekstrahere metallet er det nødvendig å redusere mineralet, det vil si å få krommetallsenteret til å få elektroner ved å påvirke et reduksjonsmiddel. Dette gjøres med karbon eller aluminium:
FeCrtoELLER4 + 4C => Fe + 2Cr + 4CO
Også kromitt (PbCrO4).
Vanligvis i ethvert mineral der Cr ion3+ kan erstatte Al3+, begge med litt like ioniske radier, utgjør en urenhet som resulterer i en annen naturlig kilde til dette fantastiske, men skadelige metall.
Referanser
- Tenenbaum E. Krom. Hentet fra: chemistry.pomona.edu
- Wikipedia. (2018). Krom. Hentet fra: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (6. april 2018). Hva er forskjellen mellom Chrome og Chromium? Hentet fra: thoughtco.com
- N.V. Mandich. (nitten nitti fem). Kjemi av krom. [PDF]. Hentet fra: citeseerx.ist.psu.edu
- Kjemi LibreTexts. Kjemi av krom. Hentet fra: chem.libretexts.org
- Saul 1. Shupack. (1991). Kjemien til krom og noen resulterende analytiske problemer. Vurdert fra: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Krom. Hentet fra: chemistryexplained.com



Ingen har kommentert denne artikkelen ennå.