
Hva er vektlovene i kjemi? (Eksempler)
De vektlover for kjemi Det er de som har vist at massene av stoffene som reagerer ikke gjør det vilkårlig eller tilfeldig; men ved å opprettholde en konstant matematisk andel av heltall eller submultipler derav, der atomene til elementene verken er skapt eller ødelagt.
Tidligere har det kreves ekstraordinære resonnement for å etablere disse lovene; fordi selv om det virker for opplagt nå, før atom- eller molekylmassene til henholdsvis grunnstoffene eller forbindelsene ikke engang var kjent.

Siden det ikke var kjent nøyaktig hvor mye en mol atomer av hvert element tilsvarte, måtte kjemikere i det 18. og 19. århundre stole på de reagerende massene. Så rudimentære analytiske balanser (toppbilde) var uatskillelige følgesvenner under hundrevis av eksperimenter som var nødvendige for å etablere vektlovene..
Det er av denne grunn at når du studerer disse kjemilovene, kommer du over massemålinger i hvert øyeblikk. Takket være dette, ekstrapolerer resultatene av eksperimentene, ble det oppdaget at de kjemiske forbindelsene sigarer er alltid dannet med samme masseandel av deres bestanddeler.
Artikkelindeks
- 1 Lov om bevaring av masse
- 1.1 -Lavoisier eksperimenter
- 1.2 -Balanse av ligninger
- 1.3 -Beregninger
- 2 Lov med bestemte proporsjoner
- 2.1 -Illustrasjon av loven
- 2.2 -Applikasjoner
- 2.3 -Beregninger
- 3 Loven med flere proporsjoner eller Daltons lov
- 3.1 -Beregninger
- 4 Lov om gjensidige proporsjoner
- 4.1 -Eksempler
- 5 Referanser
Lov om bevaring av masse
Denne loven sier at i en kjemisk reaksjon er den totale massen av reaktantene lik den totale massen av produktene; så lenge systemet vurderes er lukket og det ikke er utveksling av masse og energi med omgivelsene.
I en kjemisk reaksjon forsvinner ikke stoffer, men blir omdannet til andre stoffer med samme masse; derav den berømte setningen: "ingenting er skapt, ingenting blir ødelagt, alt er forvandlet".
Historisk ble loven om bevaring av masse i en kjemisk reaksjon først foreslått i 1756 av Mikhail Lomonsov, som viste resultatene av sine eksperimenter i sin journal..
Senere i 1774 presenterte Antoine Levoisier, fransk kjemiker, resultatene av sine eksperimenter som tillot å etablere dette; som noen også kaller det Lavoisiers lov.
-Lavoisier eksperimenter
På Lavoisiers tid (1743-1794) var det Phlogiston-teorien, ifølge hvilke organer hadde evnen til å ta fyr eller brenne. Lavoisiers eksperimenter gjorde det mulig å forkaste denne teorien.
Lavoisier gjennomførte en rekke forbrenningsforsøk av metall. Han veide nøye materialene før og etter forbrenning i en lukket beholder, og fant ut at det var en tilsynelatende vektøkning..
Men Lavoiser, basert på sin kunnskap om oksygenens rolle i forbrenningen, konkluderte med at vektøkningen i forbrenningen skyldtes inkorporering av oksygen i det brennende materialet. Konseptet med metalloksider ble født.
Derfor forble summen av massene til metallene som ble utsatt for forbrenning og oksygen uendret. Denne konklusjonen tillot etablering av loven om bevaring av masse.
-Likningsbalansering
Loven om bevaring av masser etablerte behovet for å balansere kjemiske ligninger, og garanterte at antallet av alle elementene som deltar i en kjemisk reaksjon, både som reaktanter eller som produkter, er nøyaktig det samme..
Dette er et viktig krav for nøyaktigheten av de støkiometriske beregningene som skal utføres..
-Beregninger
Vannmoles
Hvor mange mol vann kan produseres under forbrenning av 5 mol metan i overskudd av oksygen? Vis også at loven om bevaring av materie er oppfylt..
CH4 + 2 Oto => COto + 2 timertoELLER
Når man observerer den balanserte ligningen i reaksjonen, konkluderes det med at 1 mol metan produserer 2 mol vann.
Problemet kan løses direkte med en enkel tilnærming, siden vi ikke har 1 mol, men 5 mol CH4:
Mol vann = 5 mol CH4(2 mol HtoO / 1 mol CH4)
= 10
Som tilsvarer 180 g HtoO. Også dannet 5 mol eller 220 g COto, som er lik en total masse på 400 g produkter.
For at loven om bevaring av materie skal oppfylles, må 400 g reagenser reagere; intet mer, intet mindre. Av disse 400 g tilsvarer 80 g 5 mol CH4 (multipliseres med dens molekylvekt på 16 g / mol), og 320 g ved 10 mol Oto (på samme måte med sin molekylvekt på 32 g / mol).
Forbrenning av magnesiumbånd
Et 1,50 g magnesiumbånd ble brent i en lukket beholder inneholdende 0,80 g oksygen. Etter forbrenning gjensto 0,25 g oksygen i beholderen. a) Hvilken oksygenmasse reagerte? b) Hvor mye magnesiumoksid som ble dannet?
Massen av oksygen som reagerte oppnås ved en enkel forskjell.
Forbruket oksygenmasse = (innledende masse - gjenværende masse) oksygen
= 0,80 g - 0,25 g
= 0,55 g Oto (til)
I henhold til loven om bevaring av masse,
Masse av magnesiumoksid = masse av magnesium + masse av oksygen
= 1,50 g + 0,55 g
= 2,05 g MgO (b)
Lov av bestemte proporsjoner
Joseph Louis Proust (1754-1826), fransk kjemiker, innså at i en kjemisk reaksjon reagerer de kjemiske elementene alltid i faste proporsjoner av masser for å danne en forbindelse ren spesifikk; derfor er sammensetningen konstant, uavhengig av kilde eller opprinnelse, eller hvordan den syntetiseres.
Proust i 1799 bekjente loven med bestemte proporsjoner, som sier at: "Når to eller flere elementer kombineres for å danne en forbindelse, gjør de det i et fast masseforhold." Deretter er dette forholdet løst og avhenger ikke av strategien som følges for fremstilling av forbindelsen..
Denne loven er også kjent som loven om konstant sammensetning, som sier at: "Enhver kjemisk forbindelse i en tilstand av renhet inneholder alltid de samme elementene, i en konstant andel av massen.".
-Lovillustrasjon
Jern (Fe) reagerer med svovel (S) for å danne jernsulfid (FeS), tre situasjoner kan bemerkes (1, 2 og 3):
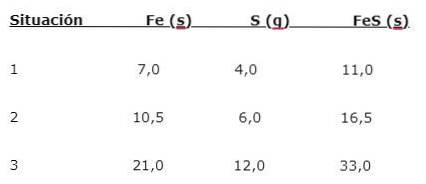
For å finne proporsjonen elementene kombineres i, del den større massen (Fe) med den mindre massen (S). Beregningen gir et forhold på 1,75: 1. Denne verdien gjentas i de tre betingelsene som er gitt (1, 2 og 3), hvor samme andel oppnås selv om forskjellige masser blir brukt..
Det vil si at 1,75 g Fe kombineres med 1,0 g S for å gi 2,75 g FeS.
-applikasjoner
Ved å anvende denne loven er det mulig å vite nøyaktig massene til elementene som må kombineres for å oppnå en ønsket masse av en forbindelse..
På denne måten kan informasjon fås om overflødig masse av ethvert av elementene som er involvert i en kjemisk reaksjon, eller om det er et begrensende reagens i reaksjonen..
I tillegg blir det brukt for å kjenne den centesimale sammensetningen av en forbindelse, og basert på sistnevnte kan formelen for en forbindelse etableres.
Centesimal sammensetning av en forbindelse
Karbondioksid (COto) dannes i følgende reaksjon:
C + Oto => COto
12 g karbon kombinerer 32 g oksygen for å gi 44 g karbondioksid.
Så prosentandelen karbon er lik
Karbonprosent = (12 g / 44 g) 100%
= 27,3%
Oksygenprosent = (32 g / 44 g) 100%
Andel oksygen = 72,7%
Ved å bruke uttalelsen fra loven om konstant sammensetning kan det bemerkes at karbondioksid alltid består av 27,3% karbon og 72,7% oksygen.
-Beregninger
Svoveltrioksid
Når 4 g og 6 g svovel (S) ble omsatt med oksygen (O) i forskjellige kar, ble 10 g og 15 g svoveltrioksid (SO3).
Hvorfor ble slike mengder svoveltrioksid oppnådd og ikke andre?
Beregn også mengden svovel som kreves for å kombinere med 36 g oksygen og den oppnådde massen av svoveltrioksid.
Del A)
I den første beholderen blandes 4 svovel med X g oksygen for å oppnå 10 g trioksid. Hvis loven om bevaring av masse blir brukt, kan vi løse oksygenmassen som kombineres med svovel.
Masse oksygen = 10 g oksygentrioksid - 4 g svovel.
= 6 g
I beholder 2 blandes 6 g svovel med X g oksygen for å oppnå 15 svoveltrioksid.
Masse oksygen = 15 g svoveltrioksid - 6 g svovel
= 9 g
Vi fortsetter deretter med å beregne O / S-forholdet for hver container:
O / S-forhold i situasjon 1 = 6 g O / 4 g S
= 1,5 / 1
O / S-forhold i situasjon 2 = 9 g O / 6 g S
= 1,5 / 1
Som er i samsvar med det som er angitt i loven om definerte proporsjoner, noe som indikerer at elementene alltid kombineres i samme proporsjon for å danne en bestemt forbindelse..
Derfor er verdiene som er oppnådd riktige og de som tilsvarer lovens anvendelse.
Del b)
I forrige avsnitt ble en verdi på 1,5 / 1 beregnet for O / S-forholdet.
g svovel = 36 oksygen (1 g svovel / 1,5 g oksygen)
= 24 g
g svoveltrioksid = 36 g oksygen + 24 g svovel
= 60 g
Klor og magnesium
Klor og magnesium kombineres i forholdet 2,95 g klor for hver g magnesium. a) Bestem massene klor og magnesium som er nødvendige for å oppnå 25 g magnesiumklorid. b) Hva er den prosentvise sammensetningen av magnesiumklorid?
Del A)
Basert på verdien 2,95 for Cl: Mg-forholdet kan følgende tilnærming gjøres:
2,95 g Cl + 1 g Mg => 3,95 g MgClto
Seinere:
g Cl = 25 g MgClto (2,95 g Cl / 3,95 g MgClto)
= 18,67
g Mg = 25 g MgClto (1 g Mg / 3,95 g MgClto)
= 6,33
Så 18,67 g klor kombineres med 6,33 g magnesium for å produsere 25 g magnesiumklorid..
Del b)
Beregn først molekylmassen av magnesiumklorid, MgClto:
Molekylvekt MgClto = 24,3 g / mol + (2 35,5 g / mol)
= 95,3 g / mol
Magnesiumprosent = (24,3 g / 95,3 g) x 100%
= 25,5%
Klorprosent = (71 g / 95,3 g) x 100%
= 74,5%
Lov av flere proporsjoner eller Daltons lov
Loven ble uttalt i 1803 av den franske kjemikeren og meteorologen John Dalton, basert på hans observasjoner angående reaksjonene fra atmosfæriske gasser..
Loven ble uttalt på følgende måte: "Når elementer kombineres for å gi mer enn en forbindelse, blir en variabel masse av en av dem sammen med en fast masse av den andre, og den første har som et forhold mellom kanoniske og utydelige tall".
Også: "Når to elementer kombineres for å stamme fra forskjellige forbindelser, gitt en fast mengde av en av dem, er de forskjellige mengdene av det andre elementet som kombineres med den faste mengden for å produsere forbindelsene, i forhold til enkle heltall".
John Dalton laget den første moderne beskrivelsen av atomet som en komponent i de kjemiske elementene, da han påpekte at elementene består av udelbare partikler som kalles atomer..
I tillegg postulerte han at forbindelser dannes når atomer med forskjellige grunnstoffer kombineres med hverandre i enkle heltallforhold..
Dalton fullførte etterforskningsarbeidene til Proust. Han påpekte eksistensen av to tinnoksider, med prosent på 88,1% og 78,7% tinn med tilsvarende prosentandel oksygen, henholdsvis 11,9% og 21,3%..
-Beregninger
Vann og hydrogenperoksid
Vis at forbindelsene vann, HtoO og hydrogenperoksid, HtoELLERto, overholde loven om flere proporsjoner.
Elementets atomvekter: H = 1 g / mol og oksygen = 16 g / mol.
Molekylvekter av forbindelser: HtoO = 18 g / mol og HtoELLERto = 34 g / mol.
Hydrogen er elementet med en fast mengde i HtoO og HtoELLERto, slik at proporsjonene mellom O og H i begge forbindelser vil bli etablert.
O / H-forhold i HtoO = (16 g / mol) / (2 g / mol)
= 8/1
O / H-forhold i HtoELLERto = (32 g / mol) / (2 g / mol)
= 16/1
Forholdet mellom begge proporsjoner = (16/1) / (8/1)
= 2
Så O / H-forholdet mellom hydrogenperoksid og vann er 2, et enkelt heltall. Derfor er samsvar med loven om flere proporsjoner demonstrert..
Nitrogenoksider
Hvilken masse oksygen kombinerer med 3,0 g nitrogen i a) nitrogenoksid, NO og b) nitrogendioksid, NOto. Vis at NEI og NEIto overholde loven om flere proporsjoner.
Masse av nitrogen = 3 g
Atomvekter: nitrogen, 14 g / mol, og oksygen, 16 g / mol.
Beregninger
I NO kombineres ett N-atom med 1 O-atom, så oksygenmassen som kombineres med 3 g nitrogen kan beregnes ved hjelp av følgende tilnærming:
g O = g nitrogen · (PA. O / PA. N)
= 3 g (16 g / mol / 14 g / mol)
= 3,43 g O
I NEIto, ett N-atom kombineres med 2 O-atomer, så massen av oksygen som kombineres er:
g oksygen = 3 g (32 g / mol / 14 g / mol)
= 6,86 g O
O / N-forhold i NO = 3,43 g O / 3 g N
= 1143
O / N-forhold i NOto = 6,86 g O / 3 g N
= 2282
Verdien av forholdet mellom O / N-proporsjonene = 2282/1143
= 2
Så verdien av O / N-forholdet er 2, et enkelt heltall. Derfor er loven om flere proporsjoner oppfylt..
Gjensidige proporsjoner lov
Denne loven formulert av Richter og Carl F. Wenzel hver for seg, fastslår at masseforholdene til to forbindelser med et grunnstoff til felles, gjør det mulig å bestemme andelen av en tredje forbindelse blant de andre elementene hvis de reagerer.
For eksempel, hvis du har de to forbindelsene AB og CB, kan du se at det vanlige elementet er B.
Richter-Wenzel-loven eller gjensidige proporsjonsloven sier at, å vite hvor mye av A som reagerer med B for å gi AB, og hvor mye av C som reagerer med B for å gi CB, kan vi beregne massen av A som er nødvendig for å reagere med en masse av C for å danne AC.
Og resultatet er at forholdet A: C eller A / C må være et multiplum eller delmultipel av A / B eller C / B. Imidlertid er denne loven ikke alltid oppfylt, spesielt når elementene presenterer forskjellige oksidasjonstilstander..
Av alle de underlige lovene er dette kanskje den mest "abstrakte" eller kompliserte. Men hvis den analyseres fra et matematisk synspunkt, vil det sees at den bare består av konverteringsfaktorer og kanselleringer.
-Eksempler
Metan
Hvis det er kjent at 12 g karbon reagerer med 32 g oksygen for å danne karbondioksid; og at derimot 2 g hydrogen reagerer med 16 g oksygen for å danne vann, så kan masseproporsjonene C / O og H / O for CO estimeresto og HtoEller henholdsvis.
Beregning av C / O og H / O har vi:
C / O = 12 g C / 32 g O
= 3/8
H / O = 2 g H / 16 g O
= 1/8
Oksygen er det vanlige elementet, og du vil vite hvor mye karbon som reagerer med hydrogen for å produsere metan; det vil si at du vil beregne C / H (eller H / C). Deretter er det nødvendig å gjøre en inndeling av de tidligere proporsjonene for å vise om gjensidighet er oppfylt:
C / H = (C / O) / (H / O)
Merk at på denne måten blir O-ene kansellert og C / H forblir:
C / H = (3/8) / (1/8)
= 3
Og 3 er et multiplum av 3/8 (3/8 x 8). Dette betyr at 3 g C reagerer med 1 g H for å gi metan. Men, for å kunne sammenligne det med COto, multipliser C / H med 4, som er lik 12; dette gir 12 g C som reagerer med 4 g H for å danne metan, noe som også er sant.
Magnesiumsulfid
Hvis det er kjent at 24 g magnesium reagerer med 2 g hydrogen for å danne magnesiumhydrid; og at i tillegg 32 g svovel reagerer med 2 g hydrogen for å danne hydrogensulfid, elementet til felles er hydrogen og vi ønsker å beregne Mg / S fra Mg / H og H / S.
Deretter beregner vi Mg / H og H / S hver for seg:
Mg / H = 24 g Mg / 2 g H
= 12
H / S = 2g H / 32g S
= 1/16
Imidlertid er det praktisk å bruke S / H for å avbryte H. Derfor er S / H lik 16. Når dette er gjort, fortsetter vi med å beregne Mg / S:
Mg / S = (Mg / H) / (S / H)
= (12/16)
= 3/4
Og 3/4 er en delmultipel på 12 (3/4 x 16). Mg / S-forholdet indikerer at 3 g Mg reagerer med 4 g svovel for å danne magnesiumsulfid. Du må imidlertid multiplisere Mg / S med 8 for å kunne sammenligne det med Mg / H. Dermed reagerer 24 g Mg med 32 g svovel for å gi dette metallsulfidet.
Aluminiumklorid
Det er kjent at 35,5 g Cl reagerer med 1 g H for å danne HC1. På samme måte reagerer 27 g Al med 3 g H for å danne AlH3. Beregn andelen aluminiumklorid og fortell om en slik forbindelse overholder Richter-Wenzel-loven.
Igjen fortsetter vi å beregne Cl / H og Al / H hver for seg:
Cl / H = 35,5 g Cl / 1 g H
= 35,5
Al / H = 27g Al / 3g H
= 9
Nå beregnes Al / Cl:
Al / Cl = (Al / H) / (Cl / H)
= 9 / 35,5
≈ 0.250 eller 1/4 (faktisk 0.253)
Det vil si at 0,250 g Al reagerer med 1 g Cl for å danne det tilsvarende salt. Men igjen må Al / Cl multipliseres med et tall som gjør det mulig å sammenligne det (for enkelhets skyld) med Al / H.
Beregnings unøyaktigheter
Al / Cl multipliseres deretter med 108 (27 / 0.250), og gir 27 g Al som reagerer med 108 g Cl. Dette er ikke akkurat tilfelle. Hvis vi for eksempel tar verdien 0,253 ganger Al / Cl, og multipliserer den med 106,7 (27 / 0,253), vil vi ha at 27 g Al reagerer med 106,7 g Cl; som er nærmere virkeligheten (AlCl3, med en PA på 35,5 g / mol for Cl).
Her er hvordan Richters lov kan begynne å vakle på grunn av presisjon og misbruk av desimaler..
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Flores, J. Química (2002). Redaksjonell Santillana.
- Joaquín San Frutos Fernández. (s.f.). De underlige og volumetriske lovene. Gjenopprettet fra: encina.pntic.mec.es
- Toppr. (s.f.). Lov om kjemisk kombinasjon. Gjenopprettet fra: toppr.com
- Strålende. (2019). Lov om kjemisk kombinasjon. Gjenopprettet fra: brilliant.org
- Kjemi LibreTexts. (2015, 15. juli). Grunnleggende kjemiske lover. Gjenopprettet fra: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (18. januar 2019). Law of Conservation of Mass. Gjenopprettet fra: thoughtco.com



Ingen har kommentert denne artikkelen ennå.