
Deuteriums struktur, egenskaper og bruksområder
De deuterium er en av de isotopiske artene av hydrogen, som er representert som D eller toH. Videre har det blitt kalt tungt hydrogen, fordi massen er dobbelt så stor som protonen. En isotop er en art som kommer fra det samme kjemiske elementet, men hvis massetall er forskjellig fra dette.
Dette skillet skyldes forskjellen i antall nøytroner den har. Deuterium regnes som en stabil isotop og kan finnes i naturlig forekommende hydrogenforbindelser, men i en ganske liten andel (mindre enn 0,02%).
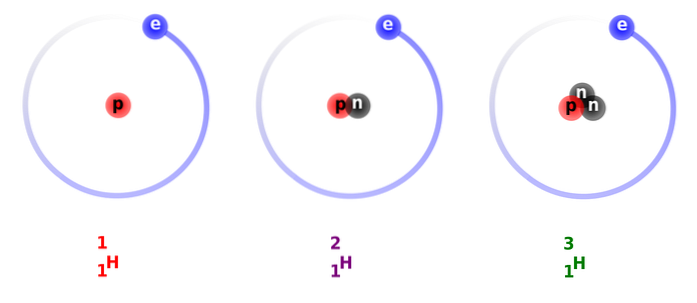
Gitt dens egenskaper, veldig lik de som vanlig hydrogen, kan den erstatte hydrogen i alle reaksjonene det deltar i, og blir til like stoffer..
Av denne og andre grunner har denne isotopen et stort antall applikasjoner innen forskjellige vitenskapsområder, og blir en av de viktigste.
Artikkelindeks
- 1 Struktur
- 1.1 Noen fakta om deuterium
- 2 eiendommer
- 3 bruksområder
- 4 Referanser
Struktur
Strukturen til deuterium består hovedsakelig av en kjerne som har en proton og et nøytron, med en atomvekt eller masse på omtrent 2.014 g.
Tilsvarende skylder denne isotopen oppdagelsen til Harold C. Urey, en kjemiker fra USA, og hans samarbeidspartnere Ferdinand Brickwedde og George Murphy, i 1931..
På bildet ovenfor kan du se sammenligningen mellom strukturene av hydrogenisotoper, som eksisterer i form av protium (dens mest rikelig isotop), deuterium og tritium, bestilt fra venstre til høyre.
Fremstillingen av deuterium i ren tilstand ble utført vellykket for første gang i 1933, men siden 1950-tallet har et stoff i fast fase blitt brukt og har vist stabilitet, kalt litiumdeuterid (LiD), for å erstatte deuterium og tritium i en stort antall kjemiske reaksjoner.
I denne forstand er overflod av denne isotopen blitt studert, og det er observert at andelen i vann kan variere litt, avhengig av kilden som prøven er tatt fra..
I tillegg har spektroskopistudier bestemt eksistensen av denne isotopen på andre planeter i denne galaksen..
Noen fakta om deuterium
Som nevnt ovenfor, ligger den grunnleggende forskjellen mellom hydrogenisotoper (som er de eneste som har blitt navngitt på forskjellige måter) i deres struktur, fordi antall protoner og nøytroner i en art gir den sine kjemiske egenskaper.
På den annen side elimineres deuterium som finnes inne i stjernekroppene med større hastighet enn det den har opprinnelse fra.
I tillegg anses det at andre fenomener i naturen bare danner en liten mengde av den, så produksjonen fortsetter å generere interesse i dag.
Tilsvarende har en serie undersøkelser avdekket at de aller fleste atomer som har blitt dannet av denne arten, stammer fra Big Bang; dette er grunnen til at dets tilstedeværelse blir lagt merke til på store planeter som Jupiter.
Som den vanligste måten å oppnå denne arten i naturen er når den finnes i kombinasjon med hydrogen i form av protium, fortsetter forholdet som er etablert mellom andelen av begge artene innen forskjellige vitenskapsfelt, å vekke interessen til det vitenskapelige samfunnet. slik som astronomi eller klimatologi.
Eiendommer
- Det er en isotop blottet for radioaktive egenskaper; det vil si at den er ganske stabil i naturen.
- Det kan brukes til å erstatte hydrogenatomet i kjemiske reaksjoner.
- Denne arten viser en oppførsel som er forskjellig fra vanlig hydrogen i reaksjoner av biokjemisk karakter..
- Når de to hydrogenatomene byttes ut i vann, får vi DtoEller å skaffe seg navnet på tungt vann.
- Hydrogenet som er til stede i havet i form av deuterium, eksisterer i en andel på 0,016% i forhold til protiumet.
- I stjerner har denne isotopen en tendens til å smelte sammen raskt og gi opphav til helium..
- DtoO er en giftig art, selv om dens kjemiske egenskaper er veldig lik Hto
- Når deuteriumatomer utsettes for kjernefusjonsprosessen ved høye temperaturer, frigjøres store mengder energi.
- Fysiske egenskaper som kokepunkt, tetthet, fordampningsvarme, trippelpunkt, blant andre, har høyere størrelser i deuteriummolekyler (Dto) enn i hydrogen (Hto).
- Den vanligste formen der den finnes er bundet til et hydrogenatom og forårsaker hydrogendeuterid (HD).
applikasjoner
På grunn av dets egenskaper brukes deuterium i et bredt spekter av applikasjoner der hydrogen er involvert. Noen av disse bruksområdene er beskrevet nedenfor:
- Innen biokjemi brukes den i isotopisk markering, som består av å "merke" en prøve med den valgte isotopen for å spore den gjennom passering gjennom et bestemt system..
- I kjernefysiske reaktorer som utfører fusjonsreaksjoner, brukes den til å redusere hastigheten nøytroner beveger seg uten den høye absorpsjonen av disse som vanlig hydrogen presenterer..
- I området kjernemagnetisk resonans (NMR) brukes løsemidler basert på deuterium for å skaffe prøver av denne typen spektroskopi uten tilstedeværelse av forstyrrelser som oppstår når man bruker hydrogenerte løsemidler..
- Innen biologien studeres makromolekyler gjennom nøytronspredningsteknikker, der prøver forsynt med deuterium brukes til å redusere støy i disse kontrastegenskapene betydelig..
- Innen farmakologiområdet brukes substitusjon av hydrogen med deuterium på grunn av den kinetiske isotopiske effekten som genereres, og gjør at disse legemidlene får lengre halveringstid.
Referanser
- Britannica, E. (s.f.). Deuterium. Gjenopprettet fra britannica.com
- Wikipedia. (s.f.). Deuterium. Hentet fra en.wikipedia.org
- Chang, R. (2007). Kjemi, niende utgave. Mexico: McGraw-Hill.
- Hyperfysikk. (s.f.). Deuterium overflod. Gjenopprettet fra hyperphysics.phy-astr.gsu.edu
- ThoughtCo. (s.f.). Fakta om deuterium. Hentet fra thoughtco.com



Ingen har kommentert denne artikkelen ennå.