
Interatomiske lenker egenskaper og typer

De lenke interatomisk Det er den kjemiske bindingen som dannes mellom atomer for å produsere molekyler. Selv om forskere i dag generelt er enige om at elektroner ikke dreier seg om kjernen, trodde man gjennom historien at hvert elektron kretset rundt kjernen til et atom i et eget skall..
I dag har forskere konkludert med at elektroner svever over bestemte områder av atomet og ikke danner baner, men valensskallet brukes fortsatt til å beskrive tilgjengeligheten av elektroner..
Linus Pauling bidro til den moderne forståelsen av kjemisk binding ved å skrive boken "The Nature of Chemical Bonding" hvor han samlet ideer fra Sir Isaac Newton, Étienne François Geoffroy, Edward Frankland og spesielt Gilbert N. Lewis..
I det koblet han kvantemekanikkens fysikk med den kjemiske naturen til de elektroniske interaksjonene som oppstår når kjemiske bindinger blir laget..
Paulings arbeid fokuserte på å fastslå at ekte ioniske bindinger og kovalente bindinger ligger i endene av et bindingsspekter, og at de fleste kjemiske bindinger er klassifisert mellom disse ytterpunktene..
Pauling videreutviklet en glideskala av bindingstype styrt av elektronegativiteten til atomene som var involvert i bindingen..
Paulings enorme bidrag til vår moderne forståelse av kjemisk binding førte til at han ble tildelt Nobelprisen i 1954 for "undersøkelse av arten av kjemisk binding og dens anvendelse for å belyse strukturen til komplekse stoffer."
Levende ting består av atomer, men i de fleste tilfeller flyter disse atomene ikke bare individuelt. I stedet samhandler de normalt med andre atomer (eller grupper av atomer).
For eksempel kan atomer være forbundet med sterke bindinger og organisert i molekyler eller krystaller. Eller de kan danne midlertidige, svake bånd med andre atomer som kolliderer med dem..
Både de sterke bindingene som binder molekyler og de svake bindingene som skaper midlertidige forbindelser, er avgjørende for kroppens kjemi og for selve livets eksistens..
Atomer har en tendens til å ordne seg i de mest stabile mønstrene som er mulig, noe som betyr at de har en tendens til å fullføre eller fylle sine ytterste elektronbaner..
De knytter seg til andre atomer for å gjøre nettopp det. Kraften som holder atomer sammen i samlinger kjent som molekyler er kjent som en kjemisk binding..
Typer av interatomiske kjemiske bindinger
Metallisk binding
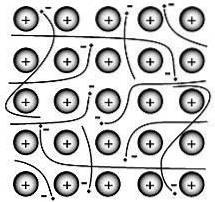
Den metalliske bindingen er kraften som holder atomene sammen i en ren metallisk substans. Et slikt fast stoff består av tett pakket atomer.
I de fleste tilfeller overlapper det ytterste elektronskallet til hvert av metallatomene med et stort antall nærliggende atomer. Som en konsekvens beveger valenselektroner kontinuerlig fra atom til atom og er ikke assosiert med noe spesifikt par atomer..
Metaller har flere kvaliteter som er unike, for eksempel evnen til å lede elektrisitet, lav ioniseringsenergi og lav elektronegativitet (slik at de lett gir opp elektroner, det vil si at de er kationer)..
Deres fysiske egenskaper inkluderer et skinnende (skinnende) utseende, og de er formbare og duktile. Metaller har en krystallinsk struktur. Imidlertid er metaller også formbare og duktile.
På 1900-tallet kom Paul Drüde opp med elektronhavsteorien ved å modellere metaller som en blanding av atomkjerner (atomkjerner = positive kjerner + indre elektronskall) og valenselektroner..
I denne modellen er valenselektronene gratis, avlokalisert, mobile og ikke assosiert med noe bestemt atom..
Jonisk bånd
Joniske bindinger er elektrostatiske. De oppstår når et element med en positiv ladning forbinder en med en negativ ladning ved coulombiske interaksjoner.
Elementer med lav ioniseringsenergi har en tendens til å miste elektroner lett, mens elementer med høy elektronaffinitet har en tendens til å få dem til å produsere henholdsvis kationer og anioner, som danner ionebindinger..
Forbindelser som viser ioniske bindinger, danner ioniske krystaller der positive og negativt ladede ioner svinger seg nær hverandre, men det er ikke alltid en direkte 1-1 korrelasjon mellom positive og negative ioner..
Joniske bindinger kan vanligvis brytes gjennom hydrogenering, eller tilsetning av vann til en forbindelse.
Stoffer som holdes sammen av ioniske bindinger (for eksempel natriumklorid) kan ofte skilles i ekte ladede ioner når de påvirkes av en ytre kraft, for eksempel når de er oppløst i vann..
Videre, i fast form, tiltrekkes ikke individuelle atomer til en individuell nabo, men danner i stedet gigantiske nettverk som tiltrekkes av hverandre av elektrostatiske interaksjoner mellom kjernen til hvert atom og nærliggende valenselektroner..
Tiltrekningskraften mellom nærliggende atomer gir ioniske faste stoffer en ekstremt ordnet struktur kjent som et ionisk gitter, der motsatt ladede partikler retter seg mot hverandre for å skape en tett bundet stiv struktur..

Kovalent binding
Kovalent binding skjer når par av elektroner deles av atomer. Atomer vil bli kovalent sammen med andre atomer for å få mer stabilitet, som oppnås ved å danne et komplett elektronskall.
Ved å dele sine ytterste (valens) elektroner kan atomer fylle det ytre skallet med elektroner og få stabilitet..
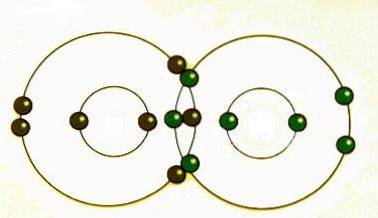
Selv om atomer sies å dele elektroner når de danner kovalente bindinger, deler de ofte ikke elektroner likt. Først når to atomer av samme element danner en kovalent binding, deles de delte elektronene faktisk likt mellom atomene..
Når atomer av forskjellige elementer deler elektroner gjennom kovalent binding, vil elektronen trekkes videre mot atomet med den høyeste elektronegativiteten, noe som resulterer i en polær kovalent binding..
Sammenlignet med ioniske forbindelser har kovalente forbindelser vanligvis et lavere smelte- og kokepunkt og er mindre sannsynlig å oppløses i vann..
Kovalente forbindelser kan være i gass, flytende eller fast tilstand og fører ikke strøm eller varme godt..
Hydrogenbindinger
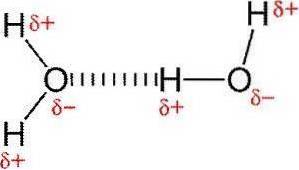
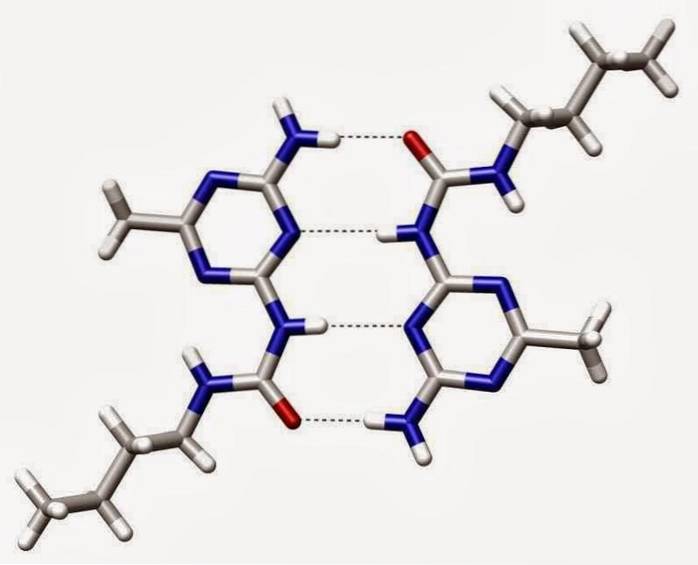
Hydrogenbindinger eller hydrogenbindinger er svake interaksjoner mellom et hydrogenatom festet til et elektronegativt element og et annet elektronegativt element.
I en polær kovalent binding som inneholder hydrogen (for eksempel en O-H-binding i et vannmolekyl), vil hydrogenet ha en liten positiv ladning fordi bindingselektronene trekkes sterkere mot det andre elementet..
På grunn av denne svake positive ladningen vil hydrogen tiltrekkes av eventuelle nærliggende negative ladninger..
Lenker til Van der Waals
De er relativt svake elektriske krefter som tiltrekker seg nøytrale molekyler til hverandre i gasser, i flytende og størknede gasser, og i nesten alle organiske og faste væsker..
Kreftene er oppkalt etter den nederlandske fysikeren Johannes Diderik van der Waals, som i 1873 først postulerte disse intermolekylære kreftene i utviklingen av en teori for å forklare egenskapene til ekte gasser..
Van der Waals-krefter er et generelt begrep som brukes til å definere tiltrekningen av intermolekylære krefter mellom molekyler..
Det er to klasser av Van der Waals-krefter: London-spredningskreftene som er svake og sterkere dipol-dipolkrefter..
Referanser
- Anthony Capri, A. D. (2003). Kjemisk binding: Naturen til den kjemiske bindingen. Hentet fra visionlearning visionlearning.com
- Camy Fung, N. M. (2015, 11. august). Kovalente bindinger. Hentet fra chem.libretexts chem.libretexts.org
- Clark, J. (2017, 25. februar). Metallisk liming. Hentet fra chem.libretexts chem.libretexts.org
- Encyclopædia Britannica. (2016, 4. april). Metallisk binding. Hentet fra britannica britannica.com.
- Encyclopædia Britannica. (2016, 16. mars). Van der Waals styrker. Hentet fra britannica britannica.com
- Kathryn Rashe, L. P. (2017, 11. mars). Van der waals styrker. Hentet fra chem.libretexts chem.libretexts.org.
- Khan, S. (S.F.). Kjemiske bindinger. Hentet fra khanacademy khanacademy.org.
- Martinez, E. (2017, 24. april). Hva er Atomic Bonding? Hentet fra sciencing sciencing.com.
- Wyzant, Inc. (S.F.). Obligasjoner. Hentet fra wyzant wyzant.com.


Ingen har kommentert denne artikkelen ennå.