
Enthalpy av reaksjonsdefinisjon, termokjemi, øvelser
De reaksjons entalpi er en termodynamisk funksjon som gjør det mulig å beregne varmen som oppnås eller leveres i en kjemisk reaksjon, forutsatt at denne reaksjonen har skjedd ved konstant trykk. Det er definert som den indre energien U pluss produktet av trykket P av volumet V av stoffene som deltar i en kjemisk reaksjon, som følger: H = U + P ∙ V
Derfor har entalpi dimensjoner av energi, og i det internasjonale målesystemet måles det i Joule. For å forstå forholdet mellom entalpi og varmen som utveksles i en kjemisk reaksjon, er det nødvendig å huske den første loven om termodynamikk, som sier følgende: Q = UU + W

Den første loven fastslår at varmen som utveksles i en termodynamisk prosess er lik variasjonen av den indre energien til stoffene som er involvert i prosessen pluss arbeidet som er gjort av nevnte stoffer i prosessen..
I en hvilken som helst prosess beregnes arbeidet W av følgende forhold:
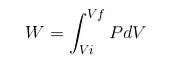
I uttrykket ovenfor er Vi det opprinnelige volumet, Vf det endelige volumet og P-trykket. Hvis prosessen utføres ved konstant trykk P, vil det resulterende arbeidet være:
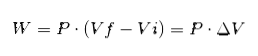
Hvor ΔV er volumendringen.
Artikkelindeks
- 1 Definisjon
- 2 Forhold til varme
- 3 Standard entalpi
- 4 Termokjemi
- 4.1 Enthalpy er en omfattende termodynamisk mengde
- 5 Øvelser løst
- 5.1-Øvelse 1
- 5.2-Øvelse 2
- 6 Referanser
Definisjon
Kjemiske reaksjoner er termodynamiske prosesser som vanligvis forekommer ved konstant trykk og veldig ofte ved atmosfærisk trykk. Denne typen termodynamiske prosesser kalles "isobar", siden den oppstår ved konstant trykk.
I dette tilfellet kan termodynamikkens første lov skrives slik:
Qp = UU + P ∙ ΔV
Hvor Qp indikerer at varmen har blitt byttet ut ved konstant trykk. Hvis definisjonen av entalpi H = U + P ∙ V er introdusert i forrige uttrykk, får vi da:
Qp = Ah
Derfor indikerer en positiv entalpiendring en reaksjon som har tatt varme fra miljøet. Dette er en endoterm reaksjon.
Tvert imot, hvis entalpiendringen er negativ, er det en eksoterm reaksjon.
Faktisk kommer ordet entalpi fra det greske ordet enthalpien, hvis betydning er "å varme".
Enthalpy kalles ofte også varme. Men det skal være klart at det ikke er det samme som varme, men det er varmevekslingen under den termodynamiske prosessen som endrer entalpi.
Forhold til varme
I motsetning til varme er entalpi en funksjon av tilstanden. Når entalpiendringen beregnes, beregnes forskjellen på to funksjoner som utelukkende avhenger av systemets tilstand, som intern energi og volum..
ΔH = ΔU + P ∙ ΔV
Siden trykket forblir konstant i reaksjonen, er reaksjonens entalpi en tilstandsfunksjon som bare avhenger av den indre energien og volumet..
I en kjemisk reaksjon kan entalpi av reaktantene defineres som summen av hver av dem; og den av produktene som summen av entalpi av alle produktene.
Entalpiendringen i en reaksjon er forskjellen mellom produktene minus reaktantene:
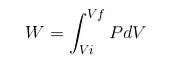
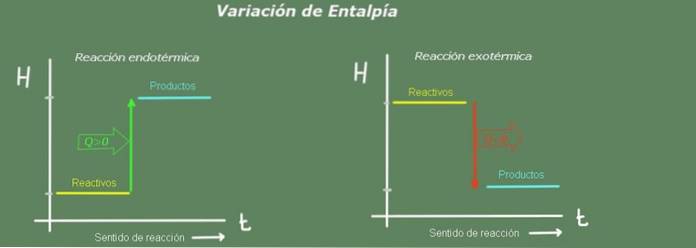
I en endoterm reaksjon er entalpi av produktene større enn reaktantene; det vil si at reaksjonen tar varme fra omgivelsene. Tvert imot, i en eksoterm reaksjon er entalpi av reaktantene større enn for produktene, siden reaksjonen gir opp varmen til miljøet.
Standard entalpi
Siden entalpiendringen i en kjemisk reaksjon kan avhenge av trykk og temperatur, er det vanlig å definere standard reaksjonsbetingelser:
Standard reaksjonstemperatur: 25 ° C.
Standard reaksjonstrykk: 1 atm = 1 bar.
Standard entalpi er betegnet slik: H °
Termokjemi
I en termokjemisk ligning har ikke bare reaktantene og produktene betydning, entalpivariasjonen har også betydning. Enthalpy forstås som reaksjonen på endringen som skjedde under den samme.
La oss som et eksempel se på følgende reaksjoner:
2 H2 (gass) + O2 (gass) → 2 H2O (væske); ΔH ° = -571,6 kJ (eksoterm).
H2 (gass) + (½) O2 (gass) → H2O (væske); ΔH ° = -285,8 kJ (eksoterm).
2 H2O (væske) → 2 H2 (gass) + O2 (gass); ΔH ° = +571.6 kJ (endoterm).
Enthalpy er en omfattende termodynamisk mengde
Hvis vilkårene for en kjemisk ligning multipliseres eller deles med en bestemt faktor, blir entalpien ganget eller delt med den samme.
Hvis reaksjonen er reversert, blir også tegnet på reaksjonsentalpi reversert.
Løst øvelser
-Øvelse 1
Acetylengass C2H2 erholdes fra reaksjonen av kalsiumkarbid CaC2 som kommer i granulert form med vann ved omgivelsestemperatur og trykk..
Som data har vi entalpiene av dannelsen av reaktantene:
ΔH ° (CaC2) = -59,0 kJ / mol
ΔH ° (H20) = -285,8 kJ / mol
Og entalpi av dannelsen av produktene:
ΔH ° (C2H2) = +227,0 kJ / mol
ΔH ° (Ca (OH) 2) = -986,0 kJ / mol
Finn standard entropi av reaksjonen.
Løsning
Det første er å foreslå en balansert kjemisk ligning:
CaC2 (s) + 2H20 (l) → Ca (OH) 2 (s) + C2H2 (g)
Og nå entalpiene til reaktantene, produktene og reaksjonen:
- Reagenser: -59,0 kJ / mol -2 ∙ 285,8 kJ / mol = -630,6 kJ / mol
- Produkter: -986,0 kJ / mol + 227,0 kJ / mol = -759 kJ / mol
- Reaksjon: ΔH ° = -759 kJ / mol - (-630 kJ / mol) = -129 kJ / mol
Det er en eksoterm reaksjon.
-Øvelse 2
Når 1 liter acetylen brennes under standardforhold, hvor mye varme blir avgitt?
Løsning
Når balansert, ser forbrenningsreaksjonen av acetylen slik ut:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Vi trenger entalpiene for dannelsen av produktene:
ΔH ° (CO2) = -393,5 kJ / mol
ΔH ° (H20 (l)) = -285,8 kJ / mol
Beregning av entalpier
Med disse dataene kan vi beregne entalpi av produktene:
ΔH ° (produkter) = 2 * (- 393,5 kJ / mol) + (-285,8 kJ / mol) = -1072,8 kJ / mol
Og entalpi av dannelsen av reaktantene:
ΔH ° (C2H2) = 227,0 kJ / mol
ΔH ° (O2) = 0,0 kJ / mol
Reagensenes entalpi vil være:
227,0 kJ / mol + (5/2) * 0,0 = 227,0 kJ / mol
Den molare reaksjonsentalpi vil da være: ΔH ° (produkter) - ΔH ° (reaktanter) = -1072,8 kJ / mol - 227,0 kJ / mol = -1299,8 kJ / mol
Enthalpy of forbrenning
Nå må vi vite hvor mange mol acetylen som er en liter acetylen under standardbetingelser. For dette vil vi bruke tilstandsligningen til en ideell gass, hvorfra vi skal løse antall mol.
Antall mol n = P * V / (R * T)
P = 1 atm = 1.013 x 10⁵ Pa
V = 1 l = 1,0 x 10 ^ -3 m³
R = 8,31 J / (mol * K)
T = 25 ° C = 298,15 K
n = 0,041 mol
Forbrennings entalpi av 1 liter acetylen er 0,041 mol * (-1299,8 kJ / mol) = -53,13 kJ
Det negative tegnet indikerer at det er en eksoterm reaksjon som gir 53,13 kJ = 12,69 kcal.
Referanser
- Kastanjer E. Enthalpy i kjemiske reaksjoner. Gjenopprettet fra: lidiaconlaquimica.wordpress.com
- Termokjemi. Reaksjonens entalpi. Gjenopprettet fra: recursostic.educacion.es
- Termokjemi. Definisjon av standard reaksjons entalpi. Gjenopprettet fra: quimitube.com
- Wikipedia. Standard reaksjonens entalpi. Gjenopprettet fra: wikipedia.com
- Wikipedia. Dannelse entalpi. Gjenopprettet fra: wikipedia.com

Ingen har kommentert denne artikkelen ennå.