
Kaliumferrocyanid egenskaper, risikoer og bruksområder
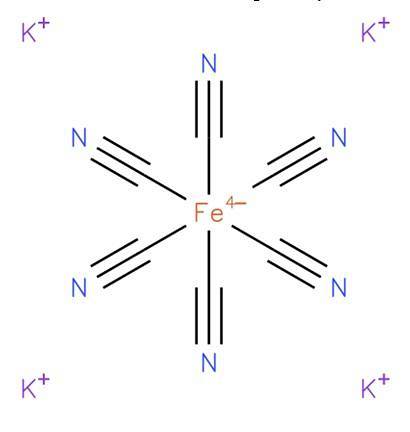
De kaliumferrocyanid, også kjent som kaliumheksacyanoferrat (II) eller preussisk gul, det er en uorganisk forbindelse med formel K4[Tro (CN)6]. Det er et kaliumsalt av ferrocyanidkoordineringskomplekset (Fe (CN)64-) og er generelt i trihydratform K4[Faith (CN)6] · HtoO. Dens struktur er vist i figur 1 (EMBL-EBI, 2008).
Historisk sett ble den laget av organisk kullsyre, jernfiler og kaliumkarbonat. Vanlige kilder til nitrogen og karbon var skrapskinn, slakteavfall eller tørket blod.
For tiden produseres kaliumferrocyanid industrielt fra hydrogencyanid, jernholdig klorid og kalsiumhydroksid, hvis kombinasjon gir Cato [Tro (CN) 6] · 11HtoELLER.
Denne løsningen blir deretter behandlet med kaliumsalter for å utfelle det blandede kalsium-kalium-CaK-saltet.to [Tro (CN) 6], som igjen behandles med kaliumkarbonat for å gi tetrakaliumsaltet.
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper
- 2 Reaktivitet og farer
- 2.1 Øyekontakt
- 2.2 Hudkontakt
- 2.3 Innånding
- 2.4 Svelging
- 3 bruksområder
- 3.1 1- Matindustri
- 3.2 2- Gruve- og metallindustri
- 3.3 3- Laboratoriereagens
- 4 Referanser
Fysiske og kjemiske egenskaper
Kaliumferrocyanid er en monoklinisk krystall med gul eller lysegul farge, avhengig av hydratiseringsnivået, uten en karakteristisk aroma (National Center for Biotechnology Information., 2017). Dens utseende er vist i figur 2 (Kaliumferrocyanid, 2017).

Forbindelsen har en molekylvekt på 368,35 g / mol for den vannfrie formen og 422,388 g / mol for trihydratformen. Den har en tetthet på 1,85 g / ml og et smeltepunkt på 70 ° C der den begynner å spaltes (Royal Society of Chemistry, 2015).
Forbindelsen er løselig i vann og er i stand til å oppløse 28,9 gram forbindelse i 100 ml av dette løsningsmidlet. Det er uoppløselig i dietyleter, etanol og toluen. Forbindelsen reagerer på varme for å danne kaliumcyanid i henhold til reaksjonen:
K4[Faith (CN)6] → 4 KCN + FeCto + Nto
I kombinasjon med konsentrerte syrer danner den hydrogencyanid (HCN) som er en svært giftig, brennbar gass og kan danne eksplosive blandinger i luften (Laffort, 2001).
Reaktivitet og farer
Kaliumferrocyanid er en stabil forbindelse, uforenlig med sterke syrer og oksidasjonsmidler. Kaliumferrocyanid er ikke giftig og brytes ikke ned i cyanid i kroppen. Toksisitet hos rotter er lav, med en dødelig dose (LD50) på 6400 mg / kg.
Stoffet er giftig for lungene og slimhinnene. Forbindelsen kan forårsake irritasjon ved kontakt med hud og øyne..
Ved inntak kan det forårsake irritasjon i mage-tarmkanalen, og ved innånding kan det irritere neseslimhinnen og luftveiene..
Kontakt med øynene kan føre til hornhinneskader eller blindhet. Kontakt med huden kan forårsake betennelse og blemmer.
Innånding av støv vil gi irritasjon i mage-tarmkanalen eller luftveiene, preget av svie, nysing og hoste. Alvorlig overeksponering kan forårsake lungeskader, kvelning, bevisstløshet eller død..
Øyekontakt
I tilfelle kontakt med øynene, bør kontaktlinsene kontrolleres og fjernes. Øyne skal skylles straks med rikelig med kaldt vann i minst 15 minutter.
Hud kontakt
Det berørte området skal skylles straks med rikelig med vann i minst 15 minutter mens forurensede klær og sko fjernes. Dekk irritert hud med et mykgjørende middel.
Vask klær og sko før de brukes på nytt. Hvis kontakten er alvorlig, vask med desinfiserende såpe og dekk forurenset hud med en antibakteriell krem.
Innånding
Offeret skal flyttes til et kjølig sted. Hvis det ikke puster, bør kunstig åndedrett gis. Hvis det er vanskelig å puste, gi oksygen.
Svelging
Hvis stoffet svelges, skal oppkast ikke induseres med mindre det er instruert av medisinsk personell. Løsne stramme klær som en skjortekrage, belte eller slips.
I alle tilfeller bør lege oppnås umiddelbart (sikkerhetsdatablad for kalium ferrocyanide trihydrat, 2013).
applikasjoner
1 - Matindustri
Preussisk gul er også kjent for sitt godkjente europeiske tilsetningsnummer: E536 og har forskjellige bruksområder i næringsmiddelindustrien. Det brukes som et antiklumpemiddel for både veisalt og bordsalt.
Det har også en ønologisk bruk for å fjerne kobber og jern i vinfremstilling. Kobber brukes som soppdrepende midler i druer (Wageningen University, 2014).
Den brukes også til gjæring av sitronsyre (D. S. Clark, 1965). Kaliumferrocyanid kan også brukes som gjødsel for planter.
2- Gruve- og metallindustri
Kaliumferrocyanid brukes til å fjerne kobber fra molybdenmineraler. Det brukes også til sementering av stål (Kaliumferrocyanid, K4Fe (CN) 6, 2012).
Sementering er en termokjemisk behandling på ståldeler. Prosessen bringer karbon til overflaten gjennom diffusjon, som impregneres ved å endre sammensetningen.
3- Laboratoriereagens
Kaliumferrocyanid brukes til å bestemme konsentrasjonen av kaliumpermanganat, en forbindelse som ofte brukes i titreringer basert på redoksreaksjoner..
Kaliumferrocyanid brukes i en blanding med kaliumferricyanid og fosfatbufret løsning for å gi en buffer for beta-galaktosidase, som brukes til å spalte X-Gal (5-brom-4-klor-3-indolyl-β-D-galaktopyranosid, gir en lyseblå visualisering der et antistoff (eller et annet molekyl), konjugert til Beta-gal, har bundet til sitt mål.
Forbindelsen brukes også til produksjon av preussisk blått. Ved reaksjon med Fe (III) gir den en preussisk blå farge, og det er derfor den brukes som et identifikasjonsreagens for jern i laboratorier..
Det brukes også til bestemmelse av sink i sinksulfidprøver. Prøven er oppløst i HCl 6N og kok under hette for å fjerne hydrogensulfid, nøytralisere med ammoniumhydroksid og tilsett 3 dråper HC1.
Varm opp til koking og tilsett 5 ml løsning 1N av kaliumferrocyanid. Tilstedeværelsen av et hvitt sinkferrocyanidutfelling indikerer en positiv test for dette elementet (Mehlig, 1927).
Referanser
- S. Clark, K. I. (1965). Effekt av kaliumferrocyanid på den kjemiske sammensetningen av melassmos brukt i sitronsyrefermentering. Bioteknologi og bioteknikk Volum 7, utgave 2, 269-278. Gjenopprettet fra onlinelibrary.wiley.com.
- EMBL-EBI. (2008, 16. januar). kaliumheksacyanoferrat (4−). Gjenopprettet fra ebi.ac.uk.
- (2001, 5. mars). POTASSIUM FERROCYANURE. Gjenopprettet fra laffort.com.
- Sikkerhetsdatablad Kaliumferrocyanidtrihydrat. (2013, 21. mai). Gjenopprettet fra sciencelab.com.
- Mehlig, J. P. (1927). Bruk av kaliumferrocyanid som bekreftende test for sink. Kjemisk utdanning 4 (6), 722. Gjenopprettet fra pubs.acs.org.
- Nasjonalt senter for bioteknologisk informasjon ... (2017, 15. april). PubChem Compound Database; CID = 161067. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Kaliumferrocyanid. (2017, 25. mars). Gjenopprettet fra sciencemadness.org.
- Kaliumferrocyanid, K4Fe (CN) 6. (2012). Gjenopprettet fra atomistry.com.
- Royal Society of Chemistry. (2015). kaliumferrocyanid. Gjenopprettet fra chemspider.com.
- Wageningen University. (2014, 14. august). E536: Kaliumferrocyanid. Gjenopprettet fra food-info.net.



Ingen har kommentert denne artikkelen ennå.