
Litiumfluoridstruktur, egenskaper, oppnåelse, bruk

De litiumfluorid det er et uorganisk fast stoff som har kjemisk formel LiF. Den består av Li-ioner+ og F- som er koblet gjennom en ionisk binding. Den finnes i små mengder i forskjellige mineraler, spesielt silikater som lepidolit, i sjøvann og i mange mineralbrønner..
Det har blitt mye brukt i optiske enheter på grunn av dets gjennomsiktighet i et bredt spekter av bølgelengder, fra det infrarøde (IR) spektret til den ultrafiolette UV, gjennom det synlige.

Det har også blitt brukt i enheter for å oppdage farlig stråling i jobber der folk blir utsatt for dem i kort tid. I tillegg brukes det som et materiale for å smelte aluminium eller for å lage briller til linser eller briller og til fremstilling av keramikk..
Fungerer som belegningsmateriale for litiumionbatterikomponenter og for å forhindre innledende tap av batterier.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3,5 Tetthet
- 3.6 Brytningsindeks
- 3.7 Løselighet
- 3.8 Andre egenskaper
- 4 Samling og plassering
- 5 bruksområder
- 5.1 I optiske applikasjoner
- 5.2 I ioniserende eller farlige strålingsdetektorer
- 5.3 Som et materiale for å forutse katoden til litiumbatterier
- 5.4 I forskjellige bruksområder
- 6 Referanser
Struktur
Litiumfluorid er en ionisk forbindelse, det vil si dannet av foreningen av Li-kationen+ og anionet F-. Kraften som holder dem sammen er elektrostatisk og kalles ionebindingen..
Når litium kombineres, gir det et elektron til fluor, og etterlater begge i en mer stabil form enn den opprinnelige, som forklart nedenfor.
Elementet litium har følgende elektroniske konfigurasjon: [He] 1sto 2s1 og når du overfører et elektron, ser den elektroniske strukturen slik ut: [He] 1sto som er mye mer stabilt.
Elementet fluor hvis elektroniske konfigurasjon er: [Ne] 1sto 2sto 2 s5, når du aksepterer elektronet, forblir det formen [Ne] 1sto 2sto 2 s6, mer stabil.
Nomenklatur
- Litiumfluorid
- Fluorolitium
- Litiummonofluorid
Eiendommer
Fysisk tilstand
Hvitt fast stoff, som krystalliserer i kubisk struktur, som natriumklorid NaCl.
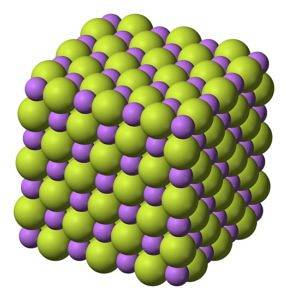
Molekylær vekt
26 g / mol
Smeltepunkt
848,2 ºC
Kokepunkt
1673 ºC, selv om den flyktiggjøres ved 1100-1200 ºC
Tetthet
2.640 g / cm3
Brytningsindeks
1.3915
Løselighet
Lett løselig i vann: 0,27 g / 100 g vann ved 18 ºC; 0,134 g / 100 g ved 25 ° C Løselig i surt medium. Uoppløselig i alkohol.
Andre egenskaper
Dampene har dimeriske arter (LiF)to og trimeric (LiF)3. Med flussyre danner HF litiumbifluorid LiHFto; med litiumhydroksyd danner et dobbelt salt LiF. LiOH.
Samling og plassering
Litiumfluorid LiF kan oppnås ved omsetning mellom flussyre HF og litiumhydroksid LiOH eller litiumkarbonat LitoCO3.
Imidlertid er den til stede i små mengder i visse mineraler som lepidolit og i sjøvann..

applikasjoner
I optiske applikasjoner
LiF brukes i form av kompakte krystaller i infrarøde (IR) spektrofotometre på grunn av den utmerkede dispersjonen de har i bølgelengdeområdet mellom 4000 og 1600 cm-1.
Store krystaller av LiF erholdes fra mettede løsninger av dette saltet. Kan erstatte naturlige fluorittkrystaller i forskjellige typer optiske apparater.
Store, rene krystaller brukes i optiske systemer for ultrafiolett (UV), synlig og IR-lys og i røntgenmonokromatorer (0,03-0,38 nm).

Det brukes også som et optisk beleggmateriale for UV-regionen på grunn av det brede optiske båndet som er større enn det for andre metallfluorider..
Dens gjennomsiktighet i langt UV (90-200 nm) gjør den ideell som et beskyttende belegg på aluminium (Al) speil. LiF / Al-speil brukes i optiske teleskopsystemer for applikasjoner i verdensrommet.
Disse beleggene oppnås ved fysisk dampavsetning og lagavsetning på atomnivå..
I ioniserende eller farlige strålingsdetektorer
Litiumfluorid har blitt mye brukt i termoluminescerende detektorer for foton, nøytron og β (beta) partikkelstråling..
Termoluminescerende detektorer sparer strålingsenergien når de blir utsatt for den. Senere, når de blir oppvarmet, frigjør de den lagrede energien i form av lys..
For denne applikasjonen er LiF generelt dopet med magnesium (Mg) og titan (Ti) urenheter. Disse urenhetene genererer visse energinivåer som fungerer som hull der elektronene som frigjøres av stråling er fanget. Når materialet deretter blir oppvarmet, går disse elektronene tilbake til sin opprinnelige energitilstand og avgir lys.
Intensiteten til lyset som avgis, avhenger direkte av energien som absorberes av materialet.
Termoluminescerende LiF-detektorer er vellykket testet for å måle komplekse felt av stråling, slik som de som er tilstede i Large Hadron Collider, eller LHC. Stor Hadron Collider), lokalisert i European Organization for Nuclear Research, kjent som CERN (for akronym fra fransk Conseil Européen pour la Recherche Nucléaire).
Strålingen i eksperimentene som ble utført i dette forskningssenteret, inneholder nåværenderoner, nøytroner og elektroner / positroner, blant andre typer subatomære partikler, som alle kan oppdages med LiF.
Som et materiale for å fortolke katoden til litiumbatterier
LiF er vellykket testet i form av nanokompositter med kobolt (Co) og jern (Fe) som materialer for forberedelse. forbrenning) av katodematerialet til litiumionbatterier.
I løpet av den første ladningssyklusen eller formasjonstrinnet til et litiumionbatteri, spaltes den organiske elektrolytten for å danne en solid fase på overflaten av anoden..
Denne prosessen forbruker litium fra katoden og reduserer energien med 5 til 20% av den totale kapasiteten til litiumionbatteriet..
Av denne grunn er den elektrokjemiske forberedelsen av katoden undersøkt, noe som genererer en elektrokjemisk ekstraksjon av litium fra nanokompositten, som fungerer som en litiumdonor, og dermed unngås forbruket av litium fra katoden..
LiF / Co og LiF / Fe nanokompositter har høy kapasitet til å donere litium til katoden, er enkle å syntetisere, stabile under miljøforhold og batteriprosessering.

I forskjellige bruksområder
Litiumfluorid brukes som sveisestrøm, spesielt aluminium, og i belegg for sveisestenger. Brukes også i aluminiumsreduksjonsceller.
Det er mye brukt ved produksjon av briller (som linser) der ekspansjonskoeffisienten synker. Den brukes også til produksjon av keramikk. I tillegg brukes den til fremstilling av emaljer og glasslakker..
LiF er en komponent av rakettdrivstoff og drivstoff for visse typer reaktorer..
LiF brukes også i lysdioder eller solcellekomponenter for injeksjon av elektroner i indre lag.
Referanser
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- OSS. National Library of Medicine. (2019). Litiumfluorid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Obryk, B. et al. (2008). Responsen til forskjellige typer TL-litiumfluoriddetektorer på høyenergiblandede strålingsfelt. Strålingsmålinger 43 (2008) 1144-1148. Gjenopprettet fra sciencedirect.com.
- Sun, Y. et al. (2016). In Situ Chemical Synthesis of Lithium Fluoride / Metal Nanocomposite for High Capacity Prelithiation of Cathodes. Nano Letters 2016, 16, 2, 1497-1501. Gjenopprettet fra pubs.acs.org.
- Hennessy, J. og Nikzad, S. (2018). Atomisk lagdeponering av optiske belegg av litiumfluorid for ultrafiolett. Uorganisk 2018, 6, 46. Gjenopprettet fra mdpi.com.


Ingen har kommentert denne artikkelen ennå.