
Kaliumfluorid (KF) struktur, egenskaper og bruksområder
De kaliumfluorid Det er et uorganisk halogenid som består av et salt dannet mellom metallet og halogenet. Den kjemiske formelen er KF, noe som betyr at for hver kation K+ det er en F- motstykke. Som det fremgår er interaksjonene elektrostatiske, og som et resultat er det ingen kovalente K-F-bindinger..
Dette saltet kjennetegnes ved sin ekstreme løselighet i vann, og det danner derfor hydrater, absorberer fuktighet og er delikatesser. Derfor er det veldig enkelt å tilberede vandige løsninger av det, som fungerer som en kilde til fluoranioner for alle de syntesene der du vil innlemme den i en eller annen struktur..
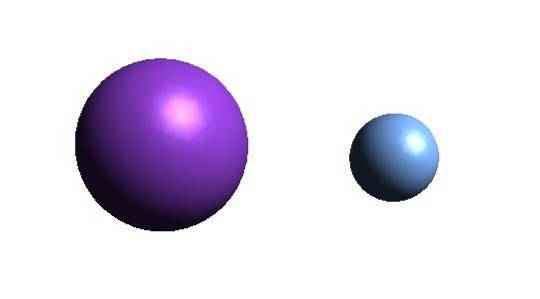
Ovenfor er kation K+ (lilla kule) og anionet F- (blålig sfære). Begge ionene samhandler og tiltrekker hverandre med +1 og -1 ladning.
Selv om KF ikke er så farlig som HF, er det faktum at den har anionen F-, gjør det til et giftig salt. Det er derfor løsningene deres har blitt brukt som insektmidler.
KI produseres ved å omsette kaliumkarbonat med flussyre og produsere kaliumbifluorid (KHFto); som ved termisk spaltning ender med opprinnelse fra kaliumfluorid.
Artikkelindeks
- 1 Struktur av kaliumfluorid
- 1.1 Hydrater
- 2 eiendommer
- 2.1 Molekylvekt
- 2.2 Fysisk utseende (farge)
- 2.3 Smak
- 2.4 Kokepunkt
- 2.5 Smeltepunkt
- 2.6 Løselighet
- 2.7 Løselighet i vann
- 2.8 Tetthet
- 2.9 Damptrykk
- 2.10 Nedbrytning
- 2.11 Etsende virkning
- 2.12 Flammepunkt
- 2.13 Eksperimentell brytningsindeks (ηD)
- 2.14 Stabilitet
- 3 bruksområder
- 3.1 Juster pH
- 3.2 Fluorkilde
- 3.3 Syntese av fluorkarboner
- 3.4 Fluorinasjon
- 3.5 Ulike
- 4 Referanser
Struktur av kaliumfluorid
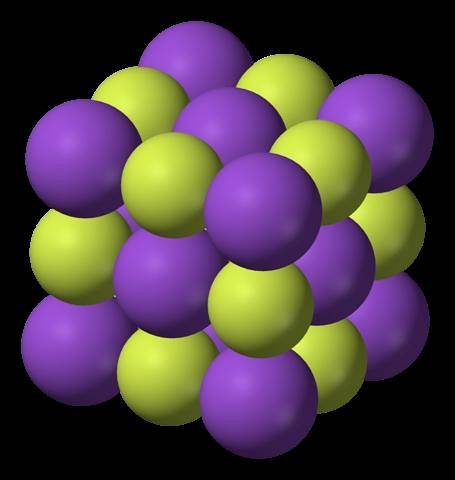
Det øvre bildet viser strukturen til kaliumfluorid. De lilla kulene, som i det første bildet, representerer K-kationene+; mens de gulaktige kulene representerer anionene F-.
Vær oppmerksom på at arrangementet er kubisk og tilsvarer en steinsaltlignende struktur, veldig lik den for natriumklorid. Alle kulene er omgitt av seks naboer, som utgjør en oktaeder KF6 eller FK6; det vil si hver K+ omgir seg med seks F-, og det samme skjer omvendt.
Det ble nevnt tidligere at KF er hygroskopisk og derfor absorberer fuktighet fra miljøet. Dette er tilfelle, vil det viste arrangementet tilsvare den vannfrie formen (uten vann) og ikke dens hydrater; som absorberer så mye vann at de til og med blir solubilisert og "smelter" (deliquescence).
Hydrater
Krystallstrukturene til hydrater blir mindre enkle. Hvorfor? For nå griper vannmolekylene direkte inn i arrangementene og samhandler med K-ionene+ og F-. En av de mest stabile hydratene er KF2HtoO og KF 4HtoELLER.
I begge hydrater deformeres oktaedraen nettopp nevnt av vannmolekylene. Dette skyldes hovedsakelig hydrogenbindinger mellom F- og HtoO (F--HOH). Krystallografiske studier har bestemt at de to ionene til tross for dette fortsatt har samme antall naboer.
Som et resultat av alt dette blir den opprinnelige kubiske strukturen for vannfritt kaliumfluorid et monoklinisk og til og med rombohedral arrangement..
Vannfrie deler delikatesser, så de hvite krystallene deres, hvis de blir i kontakt med en kald tåke, vil bli vanne på kort tid..
Eiendommer
Molekylær vekt
58,097 g / mol.
Fysisk utseende (farge)
Hvite kubiske krystaller eller deliksjent hvitt krystallinsk pulver.
Smak
Skarp salt smak.
Kokepunkt
2741 ° F til 760 mmHg (1502 ° C). I flytende tilstand blir den en leder av elektrisitet, selv om anionene F- ikke samarbeide i samme grad som K+.
Smeltepunkt
1,576 ° F; 858 ° C; 1131 K (vannfri KF). Dette er en indikasjon på dets sterke ioniske bindinger..
Løselighet
Løselig i HF, men uoppløselig i alkohol. Dette viser at hydrogenbindinger mellom fluor og alkoholer, F--HOR, ikke favoriser løseprosessen mot oppløsningen av krystallgitteret.
Vannløselighet
Vannfri 92 g / 100 ml (18 ° C); 102 g / 100 ml (25 ° C); dihydrat 349,3 g / 100 ml (18 ° C). Når KF er hydrert, blir det mer løselig i vann..
Tetthet
2,48 g / cm3.
Damptrykk
100 kPa (750 mmHg) ved 1499 ºC.
Nedbrytning
Ved oppvarming til nedbrytning avgir den giftig røyk av kaliumoksid og hydrogenfluorid..
Etsende handling
En vannet løsning tærer på glass og porselen.
Flashpoint
Det er ikke et brennbart stoff
Eksperimentell brytningsindeks (ηD)
1.363.
Stabilitet
Stabil hvis den er beskyttet mot fuktighet, ellers vil faststoffet oppløses. Uforenlig med sterke syrer og baser.
applikasjoner
Juster pH
Vandige kaliumfluoridløsninger brukes i industrielle applikasjoner og prosesser; For eksempel tillater KF-løsninger at pH justeres i produksjon i tekstilbehandlingsanlegg og i vaskerier (de tilnærmer den til verdien 7).
Fluorkilde
Kaliumfluorid er etter hydrogenfluorid, den viktigste kilden for å få fluor. Dette elementet brukes i kjernefysiske anlegg og i produksjonen av uorganiske og organiske forbindelser, noen med bruksområder som inkorporering i tannkremer..
Syntese av fluorkarboner
Kaliumfluorid kan brukes i syntesen av fluorkarbon eller fluorkarbon fra klorkarbon ved bruk av Finkeistein-reaksjonen. Etylenglykol og dimetylsulfoksyd brukes som løsningsmidler i denne reaksjonen..
Fluorinasjon
Siden det er en kilde til fluor der den ligger oppløst i vann, kan komplekse fluorider syntetiseres fra løsningene; det vil si at en F blir lagt til dem- til strukturer. Et eksempel er i følgende kjemiske ligning:
MnBrto(ac) + 3KF (ac) => KMnF3(s) + 2KBr (ac)
KMnF blandet fluor faller deretter ut3. Dermed har F- slik at det er en del av et komplekst metallsalt. I tillegg til mangan kan fluorider av andre metaller utfelles: KCoF3, KFeF3, KNiF3, KCuF3 og KZnF3.
På samme måte kan fluor inkorporeres kovalent i en aromatisk ring som syntetiserer organfluorider.
Diverse
KF brukes som et mellomprodukt eller råmateriale for syntesen av forbindelser som hovedsakelig brukes i landbrukskjemikalier eller plantevernmidler..
I tillegg brukes det som et flussmiddel for sveiser og i glassetsing; det vil si at den vandige løsningen spiser på overflaten av glasset og på en form skriver ut ønsket overflate.
Referanser
- Kjemisk bok. (2017). Kaliumfluorid. Gjenopprettet fra: chemicalbook.com
- PubChem. (2019). Kaliumfluorid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- T. H. Anderson og E. C. Lincafelte. (1951). Strukturen av kaliumfluoriddihydrat. Acta Cryst. 4, 181.
- Royal Society of Chemistry. (2015). Kaliumfluorid. ChemSpider. Gjenopprettet fra: chemspider.com
- Maquimex. (s.f.). Kaliumfluorid. Gjenopprettet fra: maquimex.com



Ingen har kommentert denne artikkelen ennå.