
Kalsiumfosfat (Ca3 (PO4) 2) struktur, egenskaper og bruksområder

De kalsiumfosfat er et uorganisk og tertiært salt hvis kjemiske formel er Ca3(PO4)to. Formelen sier at sammensetningen av dette saltet er 3: 2 for henholdsvis kalsium og fosfat. Dette kan sees direkte på bildet nedenfor, der kation Ca vises.to+ og anionen PO43-. For hver tredje Cato+ det er to PO43- samhandle med dem.
På den annen side refererer kalsiumfosfat til en serie salter som varierer avhengig av Ca / P-forholdet, samt graden av hydrering og pH. Faktisk er det mange typer kalsiumfosfater som finnes og kan syntetiseres. Imidlertid, etter nomenklaturen til punkt og prikke, refererer kalsiumfosfat bare til tricalcium, det ovennevnte.

Alle kalsiumfosfater, inkludert Ca3(PO4)to, de er helt hvite med svakt gråtoner. De kan være granulære, fine, krystallinske og ha partikkelstørrelser på rundt mikron; og til og med nanopartikler av disse fosfater er blitt fremstilt, med hvilke biokompatible materialer for bein er designet.
Denne biokompatibiliteten skyldes at disse saltene finnes i tennene og kort sagt i beinvevet hos pattedyr. For eksempel er hydroksyapatitt et krystallinsk kalsiumfosfat, som igjen samhandler med en amorf fase av det samme saltet..
Dette betyr at det er amorfe og krystallinske kalsiumfosfater. Av den grunn er det ikke overraskende mangfoldet og flere muligheter når man syntetiserer materialer basert på kalsiumfosfater; materialer hvis egenskaper hver dag er flere forskere interesserte over hele verden for å fokusere på restaurering av bein.
Artikkelindeks
- 1 Struktur av kalsiumfosfat
- 1.1 Amorf kalsiumfosfat
- 1.2 Resten av familien
- 2 Fysiske og kjemiske egenskaper
- 2.1 Navn
- 2.2 Molekylvekt
- 2.3 Fysisk beskrivelse
- 2.4 Smak
- 2.5 Smeltepunkt
- 2.6 Løselighet
- 2.7 Tetthet
- 2.8 Brytningsindeks
- 2.9 Standard formasjonens entalpi
- 2.10 Lagringstemperatur
- 2,11 pH
- 3 Trening
- 3.1 Kalsiumnitrat og ammoniumhydrogenfosfat
- 3.2 Kalsiumhydroksid og fosforsyre
- 4 bruksområder
- 4.1 I beinvev
- 4.2 Biokeramiske sementer
- 4.3 Leger
- 4.4 Andre
- 5 Referanser
Struktur av kalsiumfosfat
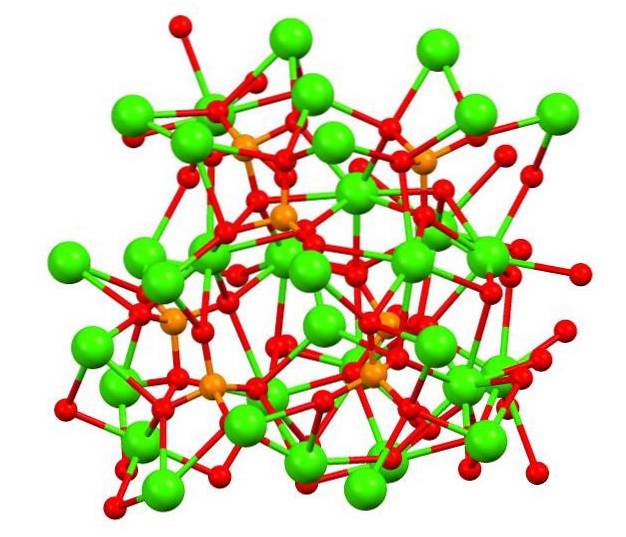
Det øvre bildet viser strukturen til tribasisk kalikofosfat i det rare mineralet whitlockite, som kan inneholde magnesium og jern som urenheter..
Selv om det ved første øyekast kan virke komplekst, er det nødvendig å avklare at modellen forutsetter kovalente interaksjoner mellom oksygenatomene til fosfater og metallsentrene av kalsium..
Som representasjon er det gyldig, men interaksjonene er elektrostatiske; det vil si kationene Cato+ tiltrekkes av PO-anioner43- (ACto+- O-PO33-). Med dette i bakhodet er det forstått hvorfor kalsiumet (grønne kuler) i bildet er omgitt av de negativt ladede oksygenatomer (røde kuler).
Fordi det er så mange ioner, etterlater det ikke et symmetrisk arrangement eller mønster synlig. Ca3(PO4)to adopterer ved lave temperaturer (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)to (β-TCP).
På høye temperaturer, derimot, forvandler den seg til polymorf α-Ca3(PO4)to (α-TCP), hvis enhetscelle tilsvarer et monoklinisk krystallsystem. Ved enda høyere temperaturer kan polymorf α'-Ca også dannes.3(PO4)to, som har en sekskantet krystallinsk struktur.
Amorf kalsiumfosfat
Krystallstrukturer er nevnt for kalsiumfosfat, som man kan forvente av et salt. Imidlertid er den i stand til å utvise uordnede og asymmetriske strukturer, knyttet mer til en type "kalsiumfosfatglass" enn til krystaller i streng forstand av definisjonen..
Når dette skjer, sies det at kalsiumfosfat har en amorf struktur (ACP, amorf kalsiumfosfat). Flere forfattere peker på denne typen struktur som ansvarlig for de biologiske egenskapene til Ca3(PO4)to i beinvev, og reparasjon og biomimetisering er mulig.
Ved å belyse strukturen ved kjernemagnetisk resonans (NMR), er tilstedeværelsen av OH-ioner funnet- og HPO4to- i AVS. Disse ionene dannes ved hydrolyse av et av fosfatene:
PO43- + HtoELLER <=> HPO4to- + Åh-
Som et resultat blir den virkelige strukturen til ACP mer kompleks, hvis sammensetning av ionene er representert med formelen: Ca9(PO4)6-x(HPO4)x(ÅH)x. 'X' indikerer graden av hydrering, siden hvis x = 1, vil formelen være som: Ca9(PO4)5(HPO4) (ÅH).
De forskjellige strukturene som ACP kan ha, avhenger av Ca / P molforholdene; det vil si av de relative mengder kalsium og fosfat, som endrer hele deres resulterende sammensetning.
Resten av familien
Kalsiumfosfater er faktisk en familie av uorganiske forbindelser, som igjen kan samhandle med en organisk matrise.
De andre fosfater oppnås "ganske enkelt" ved å endre anionene som følger med kalsium (PO43-, HPO4to-, HtoPO4-, Åh-), samt typen urenheter i det faste stoffet. Dermed kan opptil elleve kalsiumfosfater eller mer, hver med sin egen struktur og egenskaper, være naturlig eller kunstig..
Noen fosfater og deres respektive kjemiske strukturer og formler vil bli nevnt nedenfor:
-Kalsiumhydrogenfosfat dihydrat, CaHPO4∙ 2HtoO: monoklinisk.
-Kalsiumdihydrogenfosfatmonohydrat, Ca (HtoPO4)to∙ HtoEller: triklinikk.
-Vannfri disyre-fosfat, Ca (HtoPO4)to: triklinikk.
-Octacalcium hydrogen phosphate (OCP), Ca8Hto(PO4)6: triklinikk. Det er en forløper i syntesen av hydroksyapatitt.
-Hydroxyapatite, Ca5(PO4)3OH: sekskantet.
Fysiske og kjemiske egenskaper
Navn
-Kalsiumfosfat
-Tricalcium fosfat
-Tricalcium difosfat
Molekylær vekt
310,74 g / mol.
Fysisk beskrivelse
Det er et luktfritt hvitt fast stoff.
Smak
Smakløs.
Smeltepunkt
1670 ºK (1391 ºC).
Løselighet
-Praktisk talt uløselig i vann.
-Uoppløselig i etanol.
-Løselig i fortynnet saltsyre og salpetersyre.
Tetthet
3,14 g / cm3.
Brytningsindeks
1.629
Standard formasjonens entalpi
4126 kcal / mol.
Lager temperatur
2-8 ºC.
pH
6-8 i en vandig suspensjon på 50 g / l kalsiumfosfat.
Opplæring
Kalsiumnitrat og ammoniumhydrogenfosfat
Det er mange metoder for å produsere eller danne kalsiumfosfat. En av dem består av en blanding av to salter, Ca (NO3)to∙ 4HtoO, og (NH4)toHPO4, tidligere oppløst i henholdsvis absolutt alkohol og vann. Det ene saltet gir kalsium, og det andre gir fosfat.
Fra denne blandingen utfeller ACP, som deretter utsettes for oppvarming i en ovn ved 800 ° C i 2 timer. Som et resultat av denne prosedyren oppnås β-Ca3(PO4)to. Ved nøye å kontrollere temperaturer, uro og kontakttider kan det oppstå dannelse av nanokrystaller.
Å danne polymorf α-Ca3(PO4)to det er nødvendig å varme opp fosfatet over 1000 ° C. Denne oppvarmingen utføres i nærvær av andre metallioner, som stabiliserer denne polymorfen tilstrekkelig slik at den kan brukes ved romtemperatur; det vil si at den forblir i en stabil metatilstand.
Kalsiumhydroksid og fosforsyre
Kalsiumfosfat kan også dannes ved å blande løsningene av kalsiumhydroksid og fosforsyre, noe som gir en syre-base nøytralisering. Etter en halv dag med modning i moderluten, og deres på grunn av filtrering, vasking, tørking og sikting, oppnås et granulært amorft fosfatpulver, ACP..
Dette ACP-reaksjonsproduktet ved høye temperaturer, transformert i henhold til følgende kjemiske ligninger:
2Ca9(HPO4) (PO4)5(OH) => 2Ca9(StoELLER7)0,5(PO4)5(OH) + HtoO (ved T = 446,60 ° C)
2Ca9(StoELLER7)0,5(PO4)5(OH) => 3Ca3(PO4)to + 0,5HtoO (ved T = 748,56 ° C)
På denne måten oppnås β-Ca3(PO4)to, dens vanligste og stabile polymorf.
applikasjoner
I beinvev
Ca3(PO4)to det er den viktigste uorganiske bestanddelen av benaske. Det er en komponent i transplantasjoner av erstatning av bein, som forklares med dets kjemiske likhet med mineralene som er tilstede i bein.
Kalsiumfosfatbiomaterialer brukes til å korrigere beinfeil og i belegg av titanmetallproteser. Kalsiumfosfat avsettes på dem, isolerer dem fra miljøet og reduserer titankorrosjonsprosessen..
Kalsiumfosfater, inkludert Ca3(PO4)to, De brukes til å lage keramiske materialer. Disse materialene er biokompatible og brukes for tiden til å gjenopprette tap av alveolar bein som skyldes periodontal sykdom, endodontiske infeksjoner og andre forhold..
Imidlertid bør de bare brukes til å akselerere periapical beinreparasjon, i områder der det ikke er noen kronisk bakteriell infeksjon..
Kalsiumfosfat kan brukes til å reparere beinfeil når et autogent beinimplantat ikke kan brukes. Den kan brukes alene eller i kombinasjon med en biologisk nedbrytbar og resorberbar polymer, slik som polyglykolsyre.
Biokeramiske sementer
Kalsiumfosfatsement (CPC) er et annet biokeramisk middel som brukes til reparasjon av beinvev. Den lages ved å blande pulveret av forskjellige typer kalsiumfosfater med vann og danne en pasta. Limen kan injiseres eller monteres på beinfeilen eller hulrommet.
Sement støpes, gradvis resorberes og erstattes av nydannet bein.
Leger
-Ca3(PO4)to Det er et basisk salt, så det brukes som et syrenøytraliserende middel for å nøytralisere overflødig halsbrann og øke pH. I tannkremer gir det en kilde til kalsium og fosfat for å lette prosessen med remineralisering av tennene og beinhemostase.
-Det brukes også som et kosttilskudd, selv om den billigste måten å levere kalsium på er å bruke karbonat og sitrat..
-Kalsiumfosfat kan brukes til behandling av tetany, latent hypokalsemi og vedlikeholdsterapi. I tillegg er det nyttig i kalsiumtilskudd under graviditet og amming..
-Den brukes til behandling av forurensning med radioaktive isotoper radium (Ra-226) og strontium (Sr-90). Kalsiumfosfat blokkerer absorpsjonen av radioaktive isotoper i fordøyelseskanalen, og begrenser dermed skaden forårsaket av dem.
Andre
-Kalsiumfosfat brukes som fôr til fugler. I tillegg brukes den i tannkremer for å kontrollere tannstein..
-Det brukes som et antiklumpemiddel, for eksempel for å forhindre komprimering av bordsalt.
-Det fungerer som et blekemiddel for mel. I mellomtiden hindrer det smult i uønsket farging og forbedrer tilstanden til steking..
Referanser
- Tung M.S. (1998) Kalsiumfosfater: struktur, sammensetning, løselighet og stabilitet. I: Amjad Z. (red.) Kalsiumfosfater i biologiske og industrielle systemer. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu og Honglian Dai. (2018). "Syntese, karakterisering av nano-β-trikalciumfosfat og hemming av hepatocellulære karsinomceller," Journal of Nanomaterials, vol. 2018, Artikkel-ID 7083416, 7 sider, 2018.
- Combes, Christ og Rey, Christian. (2010). Amorfe kalsiumfosfater: syntese, egenskaper og bruksområder i biomaterialer. Acta Biomaterialia, vol. 6 (nr. 9). pp. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Tricalcium fosfat. Gjenopprettet fra: en.wikipedia.org
- Abida et al. (2017). Tricalcium fosfatpulver: Klargjøring, karakterisering og komprimeringsevne. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- PubChem. (2019). Kalsiumfosfat. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Kalsiumfosfat. Science Direct. Gjenopprettet fra: sciencedirect.com

Ingen har kommentert denne artikkelen ennå.