
Semiutviklet formel hva det er og eksempler (metan, propan, butan ...)

De halvutviklet formel, Også kjent som den semi-strukturelle formelen, er det en av de mange mulige representasjonene som kan gis til molekylet til en forbindelse. Det er veldig tilbakevendende i organisk kjemi, spesielt i akademiske tekster, siden det viser riktig rekkefølge av et molekyl og dets kovalente bindinger.
I motsetning til den utviklede formelen, som er den samme som strukturformelen, viser denne ikke C-H-bindingene, og utelater dem for å forenkle representasjonen. Fra denne formelen vil enhver leser være i stand til å forstå hva ryggraden i et molekyl er; men ikke dens geometri eller noen av de stereokjemiske aspektene.
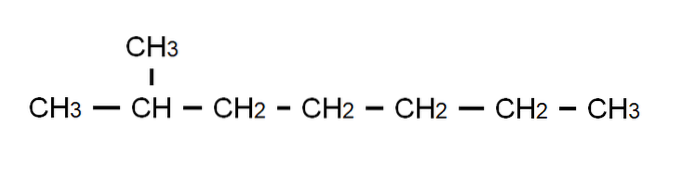
For å avklare dette punktet har vi over den semi-utviklede formelen for 2-metylheptan: en forgrenet alkan hvis molekylformel er C8H18, og som adlyder den generelle formelen CnH2n + 2. Merk at molekylformelen sier absolutt ingenting om strukturen, mens den halvutviklede formelen allerede lar oss visualisere hvordan denne strukturen er..
Vær også oppmerksom på at C-H-bindingene er utelatt, og kun fremhever C-C-bindingene som utgjør karbonkjeden eller skjelettet. Det vil sees at for enkle molekyler faller den utviklede formelen sammen med den kondenserte formelen; og til og med med molekylæren.
Artikkelindeks
- 1 Eksempler
- 1.1 Metan
- 1.2 Propan
- 1.3 Butan
- 1.4 Pentan
- 1,5 Etanol
- 1.6 Dimetyleter
- 1.7 Sykloheksan
- 1.8 Fosforsyre
- 2 Generell kommentar
- 3 Referanser
Eksempler
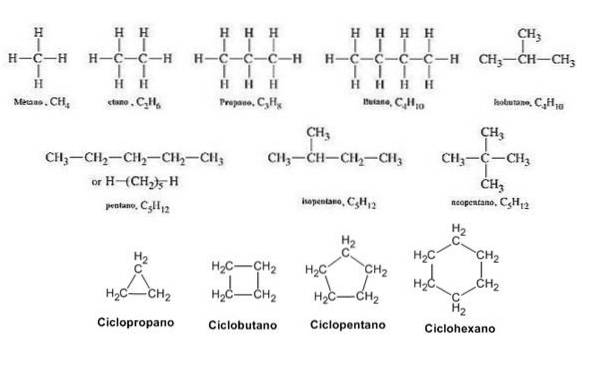
Metan
Molekylformelen til metan er CH4, da den har fire C-H-bindinger og har tetrahedral geometri. Disse dataene er gitt av strukturformelen med kiler utenfor eller under planet. For metan blir den kondenserte formelen også CH4, så vel som det empiriske og halvutviklede. Dette er den eneste forbindelsen som denne unikheten oppfylles for..
Årsaken til at den halvutviklede formelen for metan er CH4, det er fordi deres C-H obligasjoner ikke er skrevet; å gjøre det ville tilsvare strukturformelen.
Propan
Den halvutviklede formelen for propan er CH3-CHto-CH3, har bare to C-C obligasjoner. Molekylet er lineært, og hvis du merker det, er dens kondenserte formel nøyaktig den samme: CH3CHtoCH3, den eneste forskjellen er at C-C obligasjoner er utelatt. For propan er det riktig at både den halvutviklede og den kondenserte formelen sammenfaller.
Faktisk er dette sant for alle lineære kjedealkaner som vil fortsette å bli sett i de følgende avsnittene.
Butan
Den halvutviklede formelen av butan er CH3-CHto-CHto-CH3. Merk at den kan skrives på samme linje. Denne formelen tilsvarer strengt tatt den n-butan, noe som indikerer at det er den lineære og uforgrenede isomeren. Den forgrenede isomeren, 2-metylpropan, har følgende halvutviklede formel:
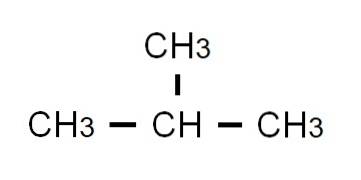
Denne gangen kan den ikke lenger skrives eller vises på samme linje. Disse to isomerer har samme molekylformel: C4H10, som ikke tjener til å diskriminere hverandre.
Pentan
Igjen har vi en annen alkan: pentan, hvis molekylformel er C5H12. Den halvutviklede formelen for n-pentan er CH3-CHto-CHto-CHto-CH3, lett å representere og tolke, uten behov for å plassere C-H-lenker. CH-grupper3 kalles metyl eller metyler, og CHto er metylener.
Pentane har andre forgrenede strukturelle isomerer, som kan sees i det nedre bildet representert av deres respektive halvutviklede formler:
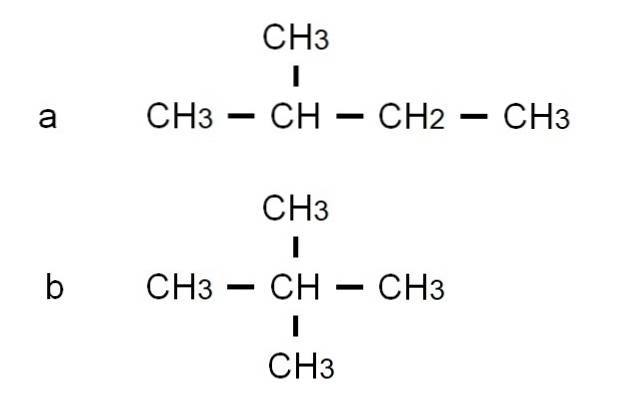
Isomeren til er 2-metylbutan, også kalt isopentan. I mellomtiden er isomeren b er 2,2-dimetylpropan, også kjent som neopentan. Dens halvutviklede formler gjør forskjellen mellom de to isomerer tydelig; Men det sier ikke mye om hvordan slike molekyler vil se ut i verdensrommet. For dette ville det være behov for strukturformler og modeller.
Etanol
Halvutviklede formler brukes ikke bare for alkaner, alkener eller alkyner, men for alle typer organiske forbindelser. Dermed har etanol, en alkohol, den halvutviklede formelen: CH3-CHto-ÅH. Merk at en C-O-binding nå er representert, men ikke O-H-bindingen. Alle hydrogenbindinger blir neglisjert.
Lineære alkoholer er enkle å fremstille som alkaner. Kort sagt: alle semi-utviklede formler for lineære molekyler er enkle å skrive.
Dimetyleter
Ethers kan også være representert med semi-utviklede formler. For tilfellet med dimetyleter, hvis molekylformel er CtoH6Eller blir den halvutviklede: CH3-O-CH3. Merk at dimetyleter og etanol er strukturelle isomerer, siden de har samme molekylformel (teller C-, H- og O-atomer).
Sykloheksan
Halvutviklede formler for forgrenede forbindelser er kjedelig å representere enn lineære; men enda mer er sykliske forbindelser, slik som cykloheksan. Dens molekylformel tilsvarer det samme som for heksen og dets strukturelle isomerer: C6H12, siden den sekskantede ringen teller som en umettethet.
For å representere cykloheksan, trekkes en sekskantet ring i hvis hjørner metylengruppene vil være lokalisert, CHto, akkurat som vist nedenfor:
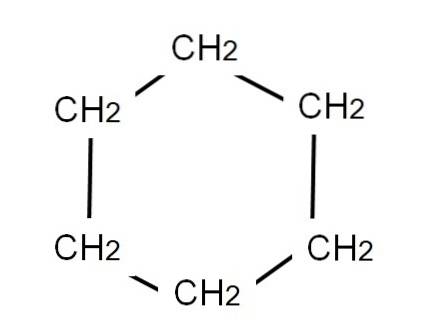
Den utviklede formelen av cykloheksan viser C-H-bindingene, som om ringen hadde TV-"antenner".
Fosforsyre
Molekylformelen av fosforsyre er H3PO3. For mange uorganiske forbindelser er molekylformelen tilstrekkelig til å gi deg en ide om strukturen. Men det er flere unntak, og dette er ett av dem. Med det faktum at H3PO3 er en diprotinsyre, den halvutviklede formelen er: HPO (OH)to.
Det vil si at ett av hydrogenene er direkte knyttet til fosforatomet. Formelen H3PO3 innrømmer også et molekyl med halvutviklet formel: PO (OH)3. Begge er faktisk det som kalles tautomerer.
Halvutviklede formler i uorganisk kjemi ligner veldig på kondensert i organisk kjemi. I uorganiske forbindelser, fordi de ikke har C-H-bindinger, og fordi de i prinsippet er enklere, er molekylformlene deres vanligvis nok til å beskrive dem (når de er kovalente forbindelser).
Generell kommentar
Semiutviklede formler er veldig vanlige når studenten lærer seg regler for nomenklatur. Men når de først er assimilert, er kjemiske notater fylt med strukturformler av skjelett-type; det vil si at ikke bare C-H-koblingene er utelatt, men tid spares også ved å ignorere C.
For resten er kondenserte formler mer tilbakevendende i organisk kjemi enn halvutviklede, siden førstnevnte ikke en gang trenger å skrive lenkene som i sistnevnte. Og når det kommer til uorganisk kjemi, er disse semi-utviklede formlene mindre brukt..
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2020). Halvutviklet formel. Gjenopprettet fra: es.wikipedia.org
- Siyavula. (s.f.). Organiske molekylære strukturer. Gjenopprettet fra: siyavula.com
- Jean Kim og Kristina Bonnett. (5. juni 2019). Tegning av organiske strukturer. Kjemi Libretexts. Gjenopprettet fra: chem.libretexts.org
- Lærere. MARL og JLA. (s.f.). Introduksjon til karbonforbindelser. [PDF]. Gjenopprettet fra: ipn.mx


Ingen har kommentert denne artikkelen ennå.