
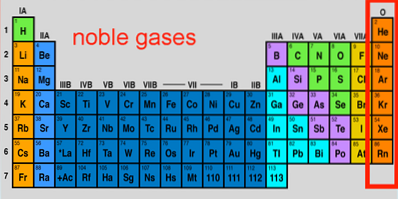
Edelgassegenskaper, konfigurasjon, reaksjoner, bruksområder

De Edelgasser De er et sett med elementer som finnes i gruppe 18 i det periodiske systemet. Gjennom årene har de også blitt kalt sjeldne eller inerte gasser, som begge er unøyaktige; noen av dem er veldig rikelig utenfor og innenfor planeten Jorden, og de er også i stand til å reagere under ekstreme forhold.
De syv elementene utgjør den kanskje mest unike gruppen i det periodiske systemet, hvis egenskaper og lave reaktiviteter er like imponerende som edelmetallene. Blant dem paraderer det mest inerte elementet (neon), det nest rikeste av Cosmos (helium) og det tyngste og mest ustabile (oganeson).

Edelgasser er de kaldeste stoffene i naturen; tåler svært lave temperaturer før kondensering. Enda vanskeligere er frysingen, siden dens intermolekylære krefter basert på London-spredning og polariserbarheten til atomene, er for svake til å knapt holde dem sammenhengende i en krystall..
På grunn av deres lave reaktivitet er de relativt sikre gasser å lagre og utgjør ikke for mange risikoer. Imidlertid kan de forflytte oksygen fra lungene og forårsake kvelning ved innånding for mye. På den annen side er to av medlemmene sterkt radioaktive elementer og derfor helseskadelige..
Den lave reaktiviteten til edelgasser brukes også for å gi reaksjonene en inert atmosfære; slik at ingen reagenser eller produkter risikerer å oksidere og påvirke synteseytelsen. Dette favoriserer også lysbuesveiseprosesser..
På den annen side er de i flytende tilstand utmerkede kryogene kjølemedier som garanterer de laveste temperaturene, som er avgjørende for riktig drift av svært energisk utstyr, eller for at noen materialer når tilstander med superledningsevne..
Artikkelindeks
- 1 Egenskaper for edelgasser
- 2 De 7 edelgassene
- 3 Elektronisk konfigurasjon
- 4 polariserbarhet
- 5 Reaksjoner
- 5.1 Helium og neon
- 5.2 Argon og krypton
- 5.3 Xenon og radon
- 6 Produksjon
- 6.1 Luft kondensering
- 6.2 Destillasjon av naturgass og radioaktive mineraler
- 7 Farer
- 8 bruksområder
- 8.1 Industri
- 8.2 Ballonger og pustetanker
- 8.3 Medisin
- 8.4 Andre
- 9 Referanser
Edelgassegenskaper
Kanskje edelgasser er elementene som har de fleste fellestrekk, både fysiske og kjemiske. Hovedegenskapene er:
- Alle er fargeløse, luktfrie og smakløse; men når de er innesluttet i ampuller ved lavt trykk, og de får elektrisk støt, ioniserer de og gir fra seg fargerike lys (toppbilde).
- Hver edelgass har sitt eget lys og spektrum.
- De er monatomiske arter, de eneste i det periodiske systemet som kan eksistere i deres respektive fysiske tilstander uten deltakelse av kjemiske bindinger (siden metaller er forbundet med metallbinding). Derfor er de perfekte for å studere egenskapene til gasser, da de tilpasser seg veldig godt til den sfæriske modellen til en ideell gass..
- Dette er vanligvis elementene med lavest smelte- og kokepunkt; så mye at helium ikke engang kan krystallisere ved absolutt null uten en økning i trykk.
- Av alle elementene er de minst reaktive, enda mindre enn edle metaller.
- Deres ioniseringsenergier er de høyeste, så vel som deres elektronegativiteter, forutsatt at de danner rent kovalente bindinger..
- Atomeradiene er også de minste fordi de er i de rette endene av hver periode..
De 7 edelgassene
De syv edelgassene, fra topp til bunn, faller ned gjennom gruppe 18 i det periodiske systemet:
-Helium, han
-Neon, Ne

-Argon, Ar
-Krypton, Kr
-Xenon, Xe

-Radon, Rn
-Oganeson, Og
Alle av dem, bortsett fra den ustabile og kunstige oganesonen, er studert for deres fysiske og kjemiske egenskaper. På grunn av sin store atommasse antas Oganeson ikke å være en gass, men en edel væske eller et fast stoff. Det er lite kjent om radon på grunn av dets radioaktivitet i forhold til helium eller argon.
Elektronisk konfigurasjon
Edelgasser har blitt sagt å ha fullstendig fylt valensskall. Så mye at deres elektroniske konfigurasjoner blir brukt til å forenkle de andre elementene ved å bruke symbolene i parentes ([He], [Ne], [Ar], etc.). Dens elektroniske konfigurasjoner er:
-Helium: 1sto, [He] (2 elektroner)
-Neon: 1sto2sto2 s6, [Ne] (10 elektroner)
-Argon: 1sto2sto2 s63sto3p6, [Ar] (18 elektroner)
-Krypton: 1sto2sto2 s63sto3p63d104sto4p6, [Kr] (36 elektroner)
-Xenon: 1sto2sto2 s63sto3p63d104sto4p64d105sto5 s6, [Xe] (54 elektroner)
-Radon: 1sto2sto2 s63sto3p63d104sto4p64d104f145sto5 s65 d106sto6p6, [Rn] (86 elektroner)
Det viktige er ikke å huske dem, men å detaljere at de ender på nstonp6: valensoktet. På samme måte er det verdsatt at dets atomer har mange elektroner, som på grunn av den store effektive atomkraften finnes i et mindre volum sammenlignet med de andre elementene; det vil si atomerradiene deres er mindre.
Derfor viser deres elektronisk tette atomstråler en kjemisk egenskap som alle edelgasser deler: de er vanskelige å polarisere..
Polariserbarhet
Edelgasser kan forestilles som sfærer av elektronskyer. Mens nedover gjennom gruppe 18 øker radiene, og på samme måte avstanden som skiller kjernen fra valenselektronene (de fra nstonp6).
Disse elektronene, ved å føle en mindre attraktiv kraft fra kjernen, kan bevege seg mer fritt; kulene blir lettere deformert jo mer omfangsrike de er. Som en konsekvens av slike bevegelser vises regioner med lave og høye elektrontettheter: δ + og δ-polene-.
Når atomet til en edelgass er polarisert, blir det en øyeblikkelig dipol som er i stand til å indusere en annen til det nærliggende atomet; det vil si at vi står overfor de spredende kreftene i London.
Derfor øker intermolekylære krefter fra helium til radon, reflektert i deres økende kokepunkter; og ikke bare det, men reaktiviteten deres økes også.
Når atomer blir mer polariserte, er det større mulighet for at deres valenselektroner deltar i kjemiske reaksjoner, hvoretter edelgassforbindelser genereres..
Reaksjoner
Helium og neon
Blant de edle gassene er de minst reaktive helium og neon. Neon er faktisk det mest inerte elementet av alle, selv om dets elektronegativitet (fra å danne kovalente bindinger) overstiger fluor.
Ingen av dets forbindelser er kjent under terrestriske forhold; Imidlertid er eksistensen av det molekylære ionet HeH ganske sannsynlig i kosmos+. Når de er elektronisk begeistret, er de i stand til å samhandle med gassatomer og danne kortvarige nøytrale molekyler kalt excimerer; slik som HeNe, CsNe og Neto.
På den annen side, selv om de ikke betraktes som forbindelser i en formell forstand, kan He- og Ne-atomer gi opphav til Van der Walls-molekyler; det vil si forbindelser som holdes "sammen" ganske enkelt av spredningskrefter. For eksempel: Ag3Han, HeCO, HeIto, CF4Ne, Ne3Clto og NeBeCO3.
På samme måte kan slike Van der Walls-molekyler eksistere takket være svake ioninduserte dipolinteraksjoner; for eksempel: Na+jeg har8, Rb+Han, Cu+Ne3 og Cu+Ne12. Merk at det til og med er mulig for disse molekylene å bli agglomerater av atomer: klynger.
Og til slutt kan He og Ne-atomer bli "fanget" eller interkalert i endohedrale komplekser av fullerener eller klatrater, uten å reagere; for eksempel: [e-postbeskyttet]60, (Nto)6Ne7, Han (HtoELLER)6 og Ne • NH4Fe (HCOO)3.
Argon og krypton
Edelgassene argon og krypton, fordi de er mer polariserbare, har en tendens til å presentere flere "forbindelser" enn helium og neon. En del av dem er imidlertid mer stabile og karakteriserbare, siden de har en lengre levetid. Blant noen av dem er HArF, og det molekylære ionet ArH+, til stede i tåker ved virkningen av kosmiske stråler.
Fra krypton begynner muligheten for å skaffe forbindelser under ekstreme, men bærekraftige forhold. Denne gassen reagerer med fluor i henhold til følgende kjemiske ligning:
Kr + Fto → KrFto
Merk at krypton får et oksidasjonsnummer på +2 (Krto+) takket være fluor. KrFto faktisk kan den syntetiseres i salgbare mengder som et oksiderende og fluorerende middel.
Argon og krypton kan etablere et bredt repertoar av klatrater, endohedrale komplekser, Van der Walls-molekyler og noen forbindelser som venter på å bli oppdaget etter deres forventede eksistens..
Xenon og radon
Xenon er, blant de edle gassene, kongen av reaktivitet. Det danner de virkelig stabile, omsettelige og karakteriserbare forbindelsene. Faktisk ligner reaktiviteten på oksygen under de aktuelle forholdene..
Hans første syntetiserte forbindelse var “XePtF6", I 1962 av Neil Bartlett. I følge litteraturen besto dette saltet faktisk av en kompleks blanding av andre fluorerte salter av xenon og platina.
Dette var imidlertid mer enn nok til å demonstrere affiniteten mellom xenon og fluor. Blant noen av disse forbindelsene har vi: XeFto, XeF4, XeF6 og [XeF]+[PtF5]-. Når XeF6 oppløses i vann, genererer et oksid:
XeF6 + 3 HtoO → XeO3 + 6 HF
Denne XeO3 kan stamme fra arten kjent som xenatos (HXeO4-) eller xeninsyre (HtoXeO4). Xenates uforholdsmessige til perxenates (XeO64-); og hvis mediet deretter surgjøres, i peroksensyre (H4XeO6), som er dehydrert til xenontetroksid (XeO4):
H4XeO6 → 2 HtoO + XeO4
Radon bør være den mest reaktive av edelgassene; Men den er så radioaktiv at den neppe rekker å reagere før den går i oppløsning. De eneste forbindelsene som er fullstendig syntetisert er fluorid (RnFto) og oksid (RnO3).
Produksjon
Flytende luft
Edelgassene blir rikere i universet når vi stiger ned gjennom gruppe 18. I atmosfæren er imidlertid helium lite, siden gravitasjonsfeltet på jorden ikke kan beholde det i motsetning til andre gasser. Det er derfor det ikke ble oppdaget i luften, men i solen.
På den annen side er det bemerkelsesverdige mengder argon i luften som kommer fra radioisotopets forfall 40K. Luft er den viktigste naturlige kilden til argon, neon, krypton og xenon på planeten.
For å produsere dem må luften først kondenseres slik at den kondenserer til en væske. Deretter gjennomgår denne væsken en fraksjonell destillasjon, og separerer dermed hver av komponentene i blandingen (Nto, ELLERto, COto, Ar osv.).
Avhengig av hvor lav temperatur og overflod av gassen må være, øker prisene, og rangerer xenon som det dyreste, mens helium er det billigste..
Destillasjon av naturgass og radioaktive mineraler
Helium er på sin side oppnådd fra en annen brøkdestillasjon; men ikke fra luften, men fra naturgass, beriket med helium takket være frigjøring av alfapartikler fra de radioaktive mineralene thorium og uran.
På samme måte blir radon "født" fra det radioaktive forfallet av radium i dets respektive mineraler; men på grunn av deres lavere overflod og den korte halveringstiden til Rn-atomene, er deres overflod latterlig sammenlignet med deres kongenere (de andre edelgassene).
Og til slutt er oganeson en svært radioaktiv, ultramassisk, menneskeskapt edel "gass" som bare kan eksistere kort under kontrollerte forhold i et laboratorium..
Farer
Hovedrisikoen for edelgasser er at de begrenser bruken av oksygen av mennesker, spesielt når en atmosfære med høy konsentrasjon av dem produseres. Det er derfor det ikke anbefales å inhalere dem for mye..
I USA er det oppdaget en høy konsentrasjon av radon i jord som er rik på uran, noe som på grunn av dets radioaktive egenskaper kan være en helserisiko..
applikasjoner
Industri
Helium og argon brukes til å skape en inert atmosfære for beskyttelse under sveising og skjæring. I tillegg brukes de til produksjon av silisiumhalvledere. Helium brukes som fyllgass i termometre.
Argon, i kombinasjon med nitrogen, brukes til fremstilling av glødelamper. Krypton blandet med halogener, som brom og jod, brukes i utladningslamper. Neon brukes i lyssignaler, blandet med fosfor og andre gasser for å fargelegge den røde fargen.
Xenon brukes i buelamper som avgir lys som ligner dagslys, som brukes i billykter og projektorer. Edelgassene blandes med halogener for å produsere ArF, KrF eller XeCl, som brukes i produksjonen av excimerlasere.
Denne typen laser produserer kortbølget ultrafiolett lys som produserer bilder med høy presisjon og brukes til fremstilling av integrerte kretser. Helium og neon brukes som kryogene kjølemediumgasser.
Ballonger og pustetanker
Helium brukes som erstatning for nitrogen i luftveisblandingen på grunn av dets lave løselighet i kroppen. Dette unngår dannelse av bobler under dekompresjonsfasen under oppstigningen, i tillegg til å eliminere nitrogennarkosen.
Helium har erstattet hydrogen som gassen som tillater heving av luftskip og luftballonger, fordi det er en lett og ikke-brennbar gass..
Medisin
Helium brukes til fremstilling av superledende magneter som brukes i kjernemagnetisk resonansutstyr: et multifunksjonsverktøy innen medisin.
Krypton brukes i halogenlamper som brukes i laserøyekirurgi og angioplastikk. Helium brukes til å lette puste hos astmatiske pasienter.
Xenon brukes som et bedøvelsesmiddel på grunn av dets høye løselighet i lipider, og antas å være fremtidens bedøvelse. Xenon brukes også i lungemedisinsk bildebehandling.
Radon, en radioaktiv edelgass, brukes i strålebehandling for noen typer kreft.
Andre
Argon brukes i syntesen av forbindelser som erstatter nitrogen som den inerte atmosfæren. Helium brukes som bærergass i gasskromatografi, så vel som i Geiger-tellere for å måle stråling.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Helmenstine, Anne Marie, Ph.D. (6. juni 2019). Noble Gases egenskaper, bruksområder og kilder. Gjenopprettet fra: thoughtco.com
- Wikipedia. (2019). Edelgass. Gjenopprettet fra: en.wikipedia.org
- Philip Ball. (18. januar 2012). Umulig kjemi: Tvinge edelgasser til å virke. Gjenopprettet fra: newscientist.com
- Professor Patricia Shapley. (2011). Edelgasskjemi. Gjenopprettet fra: butane.chem.uiuc.edu
- Gary J. Schrobilgen. (28. februar 2019). Edelgass. Encyclopædia Britannica. Gjenopprettet fra: britannica.com


Ingen har kommentert denne artikkelen ennå.