
Proteinglykosyleringstyper, prosesser og funksjoner

De proteinglykosylering Det er en posttranslasjonell modifikasjon som består av tilsetning av lineære eller forgrenede oligosakkaridkjeder til et protein. De resulterende glykoproteinene er generelt overflateproteiner og sekretoriske proteiner..
Glykosylering er en av de vanligste peptidmodifikasjonene blant eukaryote organismer, men det har vist seg å forekomme også i noen arter av archaea og bakterier..
I eukaryoter forekommer denne mekanismen mellom endoplasmatisk retikulum (ER) og Golgi-komplekset, med intervensjon av forskjellige enzymer involvert både i reguleringsprosesser og i dannelsen av kovalente bindinger med protein + oligosakkarid..
Artikkelindeks
- 1 Typer glykolyse
- 1.1 N-glykosylering
- 1.2 O-glykosylering
- 1.3 C-mannosylering
- 1.4 Glypiering (fra engelsk "Glypiation")
- 2 Prosess
- 2.1 I eukaryoter
- 2.2 I prokaryoter
- 3 funksjoner
- 3.1 Viktighet
- 4 Referanser
Typer glykolyse
Avhengig av bindingsstedet til oligosakkaridet til proteinet, kan glykosylering klassifiseres i fire typer:
N-glykosylering
Det er den vanligste av alle og oppstår når oligosakkarider binder seg til nitrogenet i amidgruppen av asparaginrester i Asn-X-Ser / Thr-motivet, hvor X kan være hvilken som helst aminosyre unntatt prolin.
ELLER-glykosylering
Når karbohydrater er bundet til hydroksylgruppen av serin, treonin, hydroksylysin eller tyrosin. Det er en mindre vanlig modifikasjon og er eksempler på proteiner som kollagen, glykoforin og muciner..
C-mannosilasjon
Den består av tilsetning av en mannoserest som binder seg til proteinet ved en C-C binding med C2 av indolgruppen i tryptofanrester.
Glipiering (fra engelsk “Glypiering ")
Et polysakkarid fungerer som en bro for å feste et protein til et glykosylfosfatidylinositol (GPI) anker på membranen.
Prosess
I eukaryoter
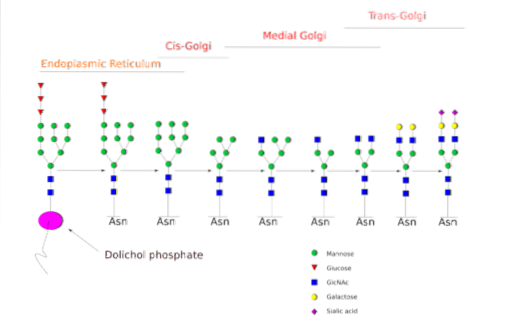
De N-glykosylering er den som har blitt studert mer detaljert. I pattedyrceller begynner prosessen i den grove ER, hvor et forhåndsdannet polysakkarid binder seg til proteiner når de kommer fra ribosomer..
Nevnte forløperpolysakkarid er sammensatt av 14 sukkerrester, nemlig: 3 glukose (Glc), 9 mannose (Man) og 2 N-acetylglukosamin (GlcNAc) rester.
Denne forløperen er vanlig hos planter, dyr og encellede eukaryote organismer. Den er bundet til membranen takket være en binding med et dolichol-molekyl, et isoprenoid lipid innebygd i ER-membranen..
Etter syntese overføres oligosakkaridet av oligosakryltransferase-enzymkomplekset til en asparaginrest inkludert i tri-peptidsekvensen Asn-X-Ser / Thr av et protein mens det blir oversatt.
De tre Glc-restene på slutten av oligosakkaridet tjener som et signal for korrekt oligosakkaridsyntese, og spaltes sammen med en av Man-restene før proteinet bæres inn i Golgi-apparatet for videre prosessering..
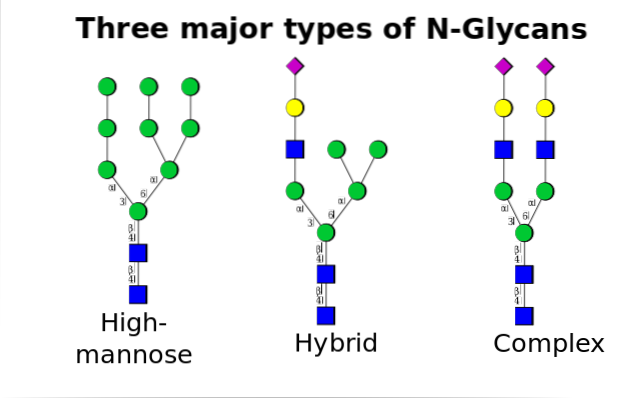
En gang i Golgi-apparatet kan oligosakkariddelene festet til glykoproteinene modifiseres ved tilsetning av galaktose, sialinsyre, fukose og mange andre rester, hvilket gir kjeder av mye større variasjon og kompleksitet..
Det enzymatiske maskineriet som er nødvendig for å utføre glykosyleringsprosessene inkluderer mange glykosyltransferaser for tilsetning av sukker, glykosidaser for fjerning av dem, og forskjellige nukleotidsukkertransportører for bidraget fra restene som brukes som substrater..
I prokaryoter
Bakterier har ikke intracellulære membransystemer, så dannelsen av det opprinnelige oligosakkaridet (av bare 7 rester) skjer på den cytosoliske siden av plasmamembranen..
Nevnte forløper syntetiseres på et lipid som deretter blir translokert av en ATP-avhengig flipase til det periplasmatiske rommet, der glykosylering forekommer..
En annen viktig forskjell mellom eukaryot og prokaryot glykosylering er at enzymet oligosakkaridtransferase (oligosacaryltransferase) fra bakterier kan overføre sukkerrester til frie deler av allerede brettede proteiner, ikke slik de blir oversatt av ribosomer..
Videre er peptidmotivet som gjenkjennes av dette enzymet ikke den samme eukaryote tri-peptidsekvensen..
Funksjoner
De N-oligosakkarider festet til glykoproteiner tjener forskjellige formål. For eksempel krever noen proteiner denne endringen etter translasjon for å oppnå riktig folding av strukturen..
For andre gir det stabilitet, enten ved å unngå proteolytisk nedbrytning eller fordi denne delen er nødvendig for at de skal oppfylle sin biologiske funksjon..
Siden oligosakkarider har en sterk hydrofil karakter, endrer deres kovalente tilsetning til et protein nødvendigvis dets polaritet og løselighet, noe som kan ha relevans fra et funksjonelt synspunkt..
Når de er festet til membranproteiner, er oligosakkarider verdifulle informasjonsbærere. De deltar i prosessene med signalisering, kommunikasjon, gjenkjenning, migrering og celleadhesjon.
De har en viktig rolle i blodpropp, helbredelse og immunrespons, så vel som i behandlingen av proteinkvalitetskontroll, som er glykanavhengig og uunnværlig for cellen..
Betydning
Minst 18 genetiske sykdommer har vært knyttet til proteinglykosylering hos mennesker, hvorav noen involverer dårlig fysisk og mental utvikling, mens andre kan være dødelige.
Det er et økende antall funn relatert til glykosyleringssykdommer, spesielt hos barn. Mange av disse lidelsene er medfødte og har å gjøre med defekter assosiert med de første stadiene av oligosakkariddannelse eller med reguleringen av enzymene som deltar i disse prosessene..
Siden en stor del av glykosylerte proteiner utgjør glykokalyksen, er det en økende interesse for å verifisere at mutasjoner eller endringer i glykosyleringsprosessene kan være relatert til endringen i mikromiljøet til tumorceller og dermed fremme progresjon av svulster og utvikling av metastaser hos kreftpasienter.
Referanser
- Aebi, M. (2013). N-koblet protein glykosylering i ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M., & Warren, C. E. (1999). Proteinglykosylering i utvikling og sykdom. BioEssays, tjueen(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H.,… Martin, K. (2003). Molekylær cellebiologi (5. utg.). Freeman, W. H. & Company.
- Luckey, M. (2008). Membranstrukturbiologi: med biokjemiske og biofysiske grunnlag. Cambridge University Press. Hentet fra www.cambrudge.org/9780521856553
- Nelson, D. L., og Cox, M. M. (2009). Lehninger prinsipper for biokjemi. Omega-utgaver (5. utg.).
- Nothaft, H., & Szymanski, C. M. (2010). Proteinglykosylering i bakterier: Søtere enn noen gang. Naturanmeldelser Mikrobiologi, 8(11), 765-778.
- Ohtsubo, K., & Marth, J. D. (2006). Glykosylering i cellulære mekanismer for helse og sykdom. Celle, 126(5), 855-867.
- Spiro, R. G. (2002). Proteinglykosylering: natur, distribusjon, enzymatisk dannelse og sykdomsimplikasjoner av glykopeptidbindinger. Glykobiologi, 12(4), 43R-53R.
- Stowell, S. R., Ju, T., og Cummings, R. D. (2015). Proteinglykosylering i kreft. Årlig gjennomgang av patologi: sykdomsmekanismer, 10(1), 473-510.
- Strasser, R. (2016). Planteprotein glykosylering. Glykobiologi, 26(9), 926-939.
- Xu, C., & Ng, D. T. W. (2015). Glykosyleringsstyrt kvalitetskontroll av proteinfolding. Naturanmeldelser Molekylær cellebiologi, 16(12), 742-752.
- Zhang, X., & Wang, Y. (2016). Glykosyleringskvalitetskontroll ved Golgi-strukturen. Journal of Molecular Biology, 428(16), 3183-3193.


Ingen har kommentert denne artikkelen ennå.