
Bariumhydroksid (Ba (OH) 2) egenskaper, risikoer og bruksområder
De bariumhydroksid er en kjemisk forbindelse med formelen Ba (OH)to(HtoELLER)x. Det er en sterk base og kan være i vannfri, monohydrat- eller oktohydratform. Monohydratformen, også kalt barittvann, er den vanligste og kommersielt brukte. Strukturen til de vannfrie og monohydratforbindelsene er presentert i figur 1.
Bariumhydroksyd kan fremstilles ved å oppløse bariumoksyd (BaO) i vann: BaO + 9HtoO → Ba (OH)to8HtoO. Det krystalliserer seg som oktahydratet, som blir monohydratet når det varmes opp i luft. Ved 100 ° C under vakuum vil monohydratet produsere BaO og vann.
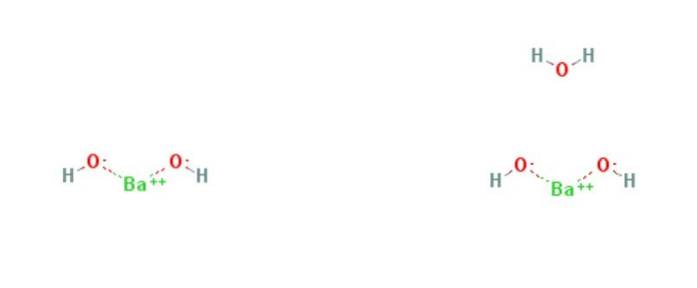
Monohydratet vedtar en lagdelt struktur (figur 2). Ba-sentreneto+ de adopterer en oktaedrisk geometri. Hvert senter Bato+ er bundet av to vannligander og seks hydroksydligander, som henholdsvis er dobbelt og tredoblet til Ba-sentreneto+ naboer.
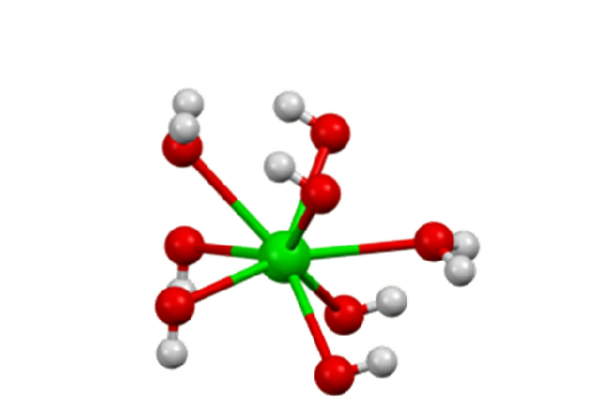
I oktahydratet sentrerer Ba segto+ Enkeltpersoner er igjen åtte koordinater, men deler ikke ligander (Barium Hydroxide, S.F.).
Artikkelindeks
- 1 Egenskaper av bariumhydroksid
- 2 Reaktivitet og farer
- 2.1 Øyekontakt
- 2.2 Hudkontakt
- 2.3 Innånding
- 2.4 Svelging
- 3 bruksområder
- 3.1 1- Industri
- 3.2 2- Laboratorium
- 3.3 3- Katalysator i Wittig-Horner-reaksjonen
- 3.4 4- Andre bruksområder
- 4 Referanser
Bariumhydroksydegenskaper
Bariumhydroksid er hvite eller gjennomsiktige oktaedriske krystaller. Luktfri og med en kaustisk smak (Nasjonalt senter for bioteknologisk informasjon., 2017). Dens utseende er vist i figur 3 (IndiaMART InterMESH Ltd., S.F.).

Den vannfrie formen har en molekylvekt på 171,34 g / mol, en tetthet på 2,18 g / ml, et smeltepunkt på 407 ° C og et kokepunkt på 780 ° C (Royal Society of Chemistry, 2015).
Monohydratformen har en molekylvekt på 189,355 g / mol, en tetthet på 3,743 g / ml og et smeltepunkt på 300 ° C (Royal Society of Chemistry, 2015).
Oktohydratformen har en molekylvekt på 315,46 g / mol, en tetthet på 2,18 g / ml og et smeltepunkt på 78 ° C (Royal Society of Chemistry, 2015).
Forbindelsen er lett løselig i vann og uoppløselig i aceton. Det er en sterk base med en pKa på 0,15 og 0,64 for første og andre OH- henholdsvis.
Bariumhydroksyd reagerer på samme måte som natriumhydroksid (NaOH), men er mindre løselig i vann. Nøytraliserer syrer eksotermisk for å danne salter pluss vann. Kan reagere med aluminium og sink for å danne metalloksider eller hydroksider og generere hydrogengass.
Kan initiere polymerisasjonsreaksjoner i polymeriserbare organiske forbindelser, spesielt epoksider.
Det kan generere brennbare og / eller giftige gasser med ammoniumsalter, nitrider, halogenerte organiske forbindelser, forskjellige metaller, peroksider og hydroperoksider. Blandinger med klorerte tannkjøtt eksploderer når de varmes opp eller knuses (BARIUM HYDROXIDE MONOHYDRATE, 2016).
Bariumhydroksid brytes ned til bariumoksid ved oppvarming til 800 ° C. Reaksjon med karbondioksid gir bariumkarbonat. Den svært alkaliske vandige løsningen gjennomgår nøytraliseringsreaksjoner med syrer. Dermed danner den bariumsulfat og bariumfosfat med henholdsvis svovelsyre og fosforsyre..
HtoSW4 + Ba (OH)to Baso4 + 2HtoELLER
Reaksjon med hydrogensulfid gir bariumsulfid. Nedbør av mange uoppløselige eller mindre oppløselige bariumsalter kan skyldes en dobbel erstatningsreaksjon når en vandig løsning av bariumhydroksyd blandes med mange løsninger av andre metallsalter..
Blanding av det faste, hydratiserte bariumhydroksydet med fast ammoniumklorid i et beger gir en endoterm reaksjon for å produsere en væske, med utvikling av ammoniakk. Temperaturen synker drastisk til omtrent -20 ° C (Royal Society of Chemistry, 2017).
Ba (OH)to (s) + 2NH4Cl (s) → BaClto (aq) + 2NH3 (g) + HtoELLER

Ba (OH) 2 reagerer med karbondioksid og produserer bariumkarbonat. Dette uttrykkes ved følgende kjemiske reaksjon:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Reaktivitet og farer
Bariumhydroksyd er klassifisert som en stabil, ikke-brennbar forbindelse som reagerer raskt og eksotermisk med syrer, og er uforenlig med karbondioksid og fuktighet. Forbindelsen er giftig og er som et sterk underlag etsende.
Innånding, svelging eller hudkontakt med materialet kan forårsake alvorlig personskade eller død. Kontakt med det smeltede stoffet kan forårsake alvorlige forbrenninger i hud og øyne..
Kontakt med huden bør unngås. Virkningene av kontakt eller innånding kan være forsinket. Brann kan produsere irriterende, etsende og / eller giftige gasser. Avløpsvann fra brannkontroll kan være etsende og / eller giftig og forårsake forurensning.
Øyekontakt
Hvis stoffet kommer i kontakt med øynene, bør kontaktlinsene kontrolleres og fjernes. Øyne skal skylles straks med mye vann i minst 15 minutter, med kaldt vann.
Hud kontakt
Ved hudkontakt skal det berørte området skylles umiddelbart i minst 15 minutter med rikelig med vann eller en svak syre, for eksempel eddik, mens forurensede klær og sko fjernes. Dekk irritert hud med et mykgjørende middel.
Vask klær og sko før de brukes på nytt. Hvis kontakten er alvorlig, vask med desinfiserende såpe og dekk forurenset hud med en antibakteriell krem..
Innånding
Ved innånding skal offeret flyttes til et kjølig sted. Hvis du ikke puster, gis kunstig åndedrett. Hvis det er vanskelig å puste, gi oksygen.
Svelging
Hvis forbindelsen svelges, bør oppkast ikke induseres. Løsne stramme klær som en skjortekrage, belte eller slips.
I alle tilfeller bør øyeblikkelig medisinsk hjelp oppnås (Sikkerhetsdatablad Bariumhydroksidmonohydrat, 2013).
applikasjoner
1- Industri
Industrielt brukes bariumhydroksyd som en forløper for andre bariumforbindelser. Monohydrat brukes til å dehydrere og fjerne sulfat fra forskjellige produkter. Denne applikasjonen utnytter den meget lave løseligheten av bariumsulfat. Denne industrielle applikasjonen gjelder også laboratoriebruk.
Bariumhydroksid brukes som tilsetningsstoff i termoplast (som fenolharpikser), riper og PVC-stabilisatorer for å forbedre plastegenskapene. Dette materialet brukes som et generelt tilsetningsstoff for smøremidler og fett..
Andre industrielle anvendelser av bariumhydroksid inkluderer sukkerfremstilling, fremstilling av såper, fettforsyning, silikatsmelting og kjemisk syntese av andre bariumforbindelser og organiske forbindelser (BARIUMHYDROKSID, S.F.).
2- Laboratorium
Bariumhydroksyd brukes i analytisk kjemi for titrering av svake syrer, spesielt organiske syrer. Den klare vandige løsningen er garantert karbonatfri, i motsetning til natriumhydroksid og kaliumhydroksid, da bariumkarbonat er uoppløselig i vann.
Dette tillater bruk av indikatorer som fenolftalein eller tymolftalein (med alkaliske fargeendringer) uten risiko for titreringsfeil forårsaket av tilstedeværelsen av karbonationer, som er mye mindre grunnleggende (Mendham, Denney, Barnes, & Thomas, 2000).
Bariumhydroksid brukes av og til i organisk syntese som en sterk base, for eksempel for hydrolyse av estere og nitriler:
Bariumhydroksid brukes også til dekarboksylering av aminosyrer som frigjør bariumkarbonat i prosessen..
Det brukes også til fremstilling av cyklopentanon, diacetonalkohol og gammalakton D - Gulonic.
3- Katalysator i Wittig-Horner-reaksjonen
Wittig-Horner-reaksjonen, også kjent som Horner-Wadsworth-Emmons-reaksjonen (eller HWE-reaksjonen) er en kjemisk reaksjon som brukes i organisk kjemi for å stabilisere fosfonatkarbanioner med aldehyder (eller ketoner) for å produsere overveiende E-alkener (trans).
Wittig-Horner sonkjemiske reaksjon katalyseres av aktivert bariumhydroksyd og utføres under fast-væske-grensesnittbetingelser..
Den sonkjemiske prosessen finner sted ved romtemperatur og med en lavere katalysatorvekt og reaksjonstid enn den termiske prosessen. Under disse forhold oppnås utbytter som tilsvarer de ved den termiske prosessen..
I arbeidet med (J. V. Sinisterra, 1987) ble påvirkningen på ytelsen til sonikeringstiden, vekten av katalysatoren og løsningsmidlet analysert. Små mengder vann må tilsettes for at reaksjonen skal finne sted.
Naturen til det aktive stedet for katalysatoren som virker i prosessen blir analysert. Det foreslås en ETC-mekanisme for den sonokjemiske prosessen.
4- Andre bruksområder
Bariumhydroksid har andre bruksområder. Den brukes til en rekke formål, for eksempel:
- Produksjon av alkali.
- Glasskonstruksjon.
- Syntetisk gummivulkanisering.
- Korrosjonshemmere.
- Som borevæsker, plantevernmidler og smøremidler.
- For kjelemediet.
- Å foredle vegetabilske og animalske oljer.
- For freskemaling.
- I mykgjøring av vann.
- Som en ingrediens i homeopatiske midler.
- Å rydde opp i syreutslipp.
- Den brukes også i sukkerindustrien til å tilberede betesukker.
- Bygningsmaterialer.
- Elektriske og elektroniske produkter.
- Gulv belegg.
Referanser
- BARIUMHYDROKSIDMONOHYDRAT. (2016). Gjenopprettet fra cameochemicals: cameochemicals.noaa.gov.
- Bariumhydroksid. (S.F.). Gjenopprettet fra chemistrylearner: chemistrylearner.com.
- BARIUMHYDROKSID. (S.F.). Gjenopprettet fra chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd ... (S.F.). Bariumhydroksid. Gjenopprettet fra indiamart: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 som katalysator i organiske reaksjoner. 17. Grensesnitt fast-væske Wittig-Horner reaksjon under sonokjemiske forhold. The Journal of Organic Chemistry 52 (17), 3875-3879. researchgate.net.
- Sikkerhetsdatablad Bariumhydroksidmonohydrat. (2013, 21. mai). Hentet fra sciencelab: sciencelab.com/msds.
- Mendham, J., Denney, R. C., Barnes, J. D., & Thomas, M. J. (2000). Vogels kvantitative kjemiske analyse (6. utg.). New York: Prentice Hall.
- Nasjonalt senter for bioteknologisk informasjon. (2017, 28. mars). PubChem Compound Database; CID = 16211219. Gjenopprettet fra PubChem: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Bariumhydroksid. Gjenopprettet fra chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Bariumhydroksydhydrat (1: 2: 1). Gjenopprettet fra chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Dihydroksybariumhydrat (1: 1). Gjenopprettet fra chemspider: chemspider.com.
- Royal Society of Chemistry. (2017). Endotermiske faste-faste reaksjoner. Gjenopprettet fra: lær-kjemi: rsc.org.


Ingen har kommentert denne artikkelen ennå.