
Sølvsulfid (Ag2S) struktur, egenskaper og bruksområder
De sølvsulfid er en uorganisk forbindelse med kjemisk formel AgtoS. Den består av et gråsvart fast stoff dannet av kationer Ag+ og S anionerto- i forholdet 2: 1. Sto- er veldig lik Ag+, fordi begge er myke ioner og klarer å stabilisere seg med hverandre.
Sølvpynt har en tendens til å bli mørkere og mister sin karakteristiske glans. Fargeendringen er ikke et produkt av oksidasjon av sølv, men av reaksjonen med hydrogensulfid til stede i miljøet ved lave konsentrasjoner; dette kan komme fra råtnende eller nedbrytning av planter, dyr eller mat rik på svovel.

HtoS, hvis molekyl bærer et svovelatom, reagerer med sølv i henhold til følgende kjemiske ligning: 2Ag (s) + HtoS (g) => AgtoS (s) + Hto(g)
Derfor vil AgtoS er ansvarlig for de svarte lagene dannet på sølv. Imidlertid kan dette sulfidet i naturen også finnes i mineralene Acantite og Argentite. De to mineralene skiller seg ut fra mange andre ved deres skinnende sorte krystaller, som den i det faste stoffet i bildet ovenfor..
AGtoS har polymorfe strukturer, attraktive elektroniske og optoelektroniske egenskaper, er en halvleder og lover å være et materiale for produksjon av solcelleanordninger, for eksempel solceller..
Artikkelindeks
- 1 Struktur
- 2 eiendommer
- 2.1 Molekylvekt
- 2.2 Utseende
- 2.3 Lukt
- 2.4 Smeltepunkt
- 2.5 Løselighet
- 2.6 Struktur
- 2.7 Brytningsindeks
- 2.8 Dielektrisk konstant
- 2.9 Elektronikk
- 2.10 Reduksjonsreaksjon
- 3 Nomenklatur
- 3.1 Systematikk
- 3.2 Lager
- 3.3 Tradisjonell
- 4 bruksområder
- 5 Referanser
Struktur
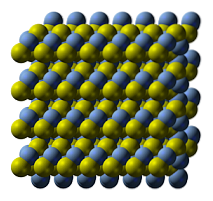
Det øvre bildet illustrerer krystallstrukturen til sølvsulfid. De blå kulene tilsvarer Ag-kationene+, mens de gule til S-anioneneto-. AGtoS er polymorf, noe som betyr at den kan ta i bruk forskjellige krystallsystemer under visse temperaturforhold..
Hvordan? Gjennom en faseovergang. Ionene er omorganisert på en slik måte at økningen i temperatur og vibrasjonene i det faste stoffet ikke forstyrrer den elektrostatiske tiltreknings-frastøtningsbalansen. Når dette skjer, sies det at det er en faseovergang, og det faste stoffet viser derfor nye fysiske egenskaper (som glans og farge)..
AGtoS ved normale temperaturer (under 179 ° C), har den en monoklinisk krystallinsk struktur (α- AgtoS). I tillegg til denne solide fasen er det to andre: bcc (kubikk sentrert på kroppen) mellom 179 og 586 ° C, og fcc (kubikk sentrert på ansiktene) ved veldig høye temperaturer (δ- AgtoS).
Mineralet argentitt består av fcc-fasen, også kjent som β-AgtoS. Når den er avkjølt og forvandlet til akantitt, er dens strukturelle egenskaper rådende kombinert. Derfor eksisterer begge krystallinske strukturer sammen: monoklin og bcc. Derfor dukker det opp svarte faste stoffer med lyse og interessante overtoner..
Eiendommer
Molekylær vekt
247,80 g / mol
Utseende
Gråsvarte krystaller
Lukt
Toalett.
Smeltepunkt
836 ° C. Denne verdien stemmer overens med at AgtoS er en forbindelse med lite ionisk karakter og smelter derfor ved temperaturer under 1000 ° C.
Løselighet
Bare i vann 6.21 ∙ 10-femten g / L ved 25 ° C Det vil si at mengden av det svarte faste stoffet som er solubilisert er ubetydelig. Dette er igjen på grunn av den lave polare karakteren til Ag-S-bindingen, hvor det ikke er noen signifikant forskjell i elektronegativitet mellom de to atomene..
Også AgtoS er uoppløselig i alle løsningsmidler. Intet molekyl kan effektivt skille sine krystallinske lag i Ag-ioner+ og Sto- solvatisert.
Struktur
På bildet av strukturen kan du også se fire lag med S-Ag-S-bindinger, som beveger seg over hverandre når det faste stoffet blir utsatt for kompresjon. Denne oppførselen betyr at, til tross for at den er en halvleder, er den duktil som mange metaller ved romtemperatur..
S-Ag-S-lag passer riktig på grunn av deres vinkelgeometrier som blir sett på som en sikksakk. Siden det er en kompresjonskraft, beveger de seg på en forskyvningsakse, og forårsaker dermed nye ikke-kovalente interaksjoner mellom sølv- og svovelatomer..
Brytningsindeks
2.2
Dielektrisk konstant
6
Elektronisk
AGtoS er en amfoter halvleder, det vil si at den oppfører seg som om den var av typen n og av typen s. I tillegg er den ikke sprø, så den har blitt studert for anvendelse i elektroniske enheter..
Reduksjonsreaksjon
AGtoS kan reduseres til metallisk sølv ved å bade de svarte bitene med varmt vann, NaOH, aluminium og salt. Følgende reaksjon finner sted:
3AgtoS (s) + 2Al (s) + 3HtoO (l) => 6Ag (s) + 3HtoS (ac) + AltoELLER3(s)
Nomenklatur
Sølv, hvis elektronkonfigurasjon er [Kr] 4d105s1, den kan bare miste ett elektron: dets ytterste orbital 5s. Dermed kation Ag+ sitter igjen med en elektronkonfigurasjon [Kr] 4d10. Derfor har den en unik valens på +1, som bestemmer hva forbindelsene skal kalles..
Svovel har derimot elektronisk konfigurasjon [Ne] 3sto3p4, og det tar to elektroner å fullføre valensoktet. Når den får disse to elektronene (fra sølv), forvandles den til sulfidanionen, Sto-, med [Ar] innstilling. Det vil si at det er isoelektronisk mot edelgassargonet.
Så AgtoS må kalles i henhold til følgende nomenklaturer:
Systematisk
Apesulfid av gasølv. Her vurderes antall atomer for hvert element, og de er merket med prefikset til greske teller.
Lager
Sølvsulfid. Siden den har en unik valens på +1, er den ikke spesifisert med romertall i parentes: sølv (I) sulfid; som er galt.
Tradisjonell
Sølvsulfidico. Siden sølv "fungerer" med en valens på +1, blir suffikset -ico lagt til navnet. argentum På latin.
applikasjoner
Noen av romanens bruksområder for AgtoS er som følger:
-De kolloidale løsningene av nanopartiklene (med forskjellige størrelser) har antibakteriell aktivitet, er ikke giftige og kan derfor brukes innen medisin og biologi..
-Dens nanopartikler kan danne det som kalles kvanteprikker. De absorberer og avgir stråling med større intensitet enn mange fluorescerende organiske molekyler, slik at de kan erstatte sistnevnte som biologiske markører.
-Strukturene til α-AgtoS får den til å utvise slående elektroniske egenskaper som skal brukes som solceller. På samme måte representerer det et utgangspunkt for syntesen av nye termoelektriske materialer og sensorer..
Referanser
- Mark Peplow. (17. april 2018). Halvledersølvsulfid strekker seg som metall. Hentet fra: cen.acs.org
- Samarbeid: Forfattere og redaktører av volumene III / 17E-17F-41C () Sølvsulfid (Ag2S) krystallstruktur. I: Madelung O., Rössler U., Schulz M. (red.) Ikke-tetraedrisk bundne elementer og binære forbindelser I. Landolt-Börnstein - Gruppe III kondensert materiale (numeriske data og funksjonelle forhold i vitenskap og teknologi), bind 41C. Springer, Berlin, Heidelberg.
- Wikipedia. (2018). Sølvsulfid. Hentet fra: en.wikipedia.org
- Stanislav I. Sadovnikov og kol. (Juli 2016). AgtoS sølvsulfid nanopartikler og kolloidale løsninger: Syntese og egenskaper. Hentet fra: sciencedirect.com
- Azo Materials. (2018). Sølvsulfid (AgtoS) Halvledere. Hentet fra: azom.com
- A. Nwofe. (2015). Utsikter og utfordringer med sølvsulfiddynne filmer: En gjennomgang. Divisjon for materialvitenskap og fornybar energi, Institutt for industriell fysikk, Ebonyi State University, Abakaliki, Nigeria.
- UMassAmherst. (2011). Forelesningsdemonstrasjoner: rengjøring av sølv. Hentet fra: lecturedemos.chem.umass.edu
- Studere. (2018). Hva er sølvsulfid? - Kjemisk formel og bruksområder. Hentet fra: study.com


Ingen har kommentert denne artikkelen ennå.