
Kobber (II) hydroksydstruktur, egenskaper, nomenklatur, bruksområder

De kobber (II) hydroksid o Cupric hydroksid er et lyseblått eller blågrønt krystallinsk uorganisk fast stoff med kjemisk formel er Cu (OH)to. Det oppnås som et voluminøst blått bunnfall ved å tilsette et alkalisk hydroksid til kobberløsninger (det betyr at de inneholder Cu-ionerto+). Det er en ustabil forbindelse.
For å øke stabiliteten tilberedes den i nærvær av ammoniakk (NH3) eller fosfater Hvis det fremstilles i nærvær av ammoniakk, dannes et materiale med god stabilitet og stor partikkelstørrelse.

Ved tilberedning av kobber (II) fosfat, Cu3(PO4)to, et materiale med finere partikkelstørrelse og større overflateareal oppnås. Cupric hydroksid er mye brukt som soppdrepende og bakteriedrepende middel i landbruket og for å behandle tre, og forlenger levetiden..
Det brukes også som kosttilskudd for dyr. Den brukes som et råmateriale for å oppnå andre kobber (II) salter og i galvanisering for å belegge overflater.
Studier pågår for å estimere potensialet for å bekjempe bakterie- og soppinfeksjoner hos mennesker..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Tetthet
- 3.5 Løselighet
- 3.6 Andre egenskaper
- 4 bruksområder
- 4.1 I landbruket
- 4.2 I konservering av tre
- 4.3 Ved produksjon av rayon
- 4.4 I dyrefôrindustrien
- 4.5 Ved fremstilling av andre kobber (II) forbindelser
- 4.6 Andre bruksområder
- 4.7 Fremtidige medisinske applikasjoner
- 5 Referanser
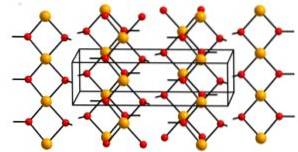
Struktur
Kobber (II) hydroksyd inneholder uendelige kjeder av kobberioner (Cuto+) bundet av broer av hydroksylgrupper (OH-).
Kjedene er så pakket at 2 oksygenatomer fra andre kjeder er over og under hvert kobberatom, og antar dermed en forvrengt oktaedrisk konfigurasjon, som er vanlig i de fleste kobber (II) forbindelser..
I sin struktur er fire oksygenatomer i en avstand på 1,93 A; to oksygenatomer er ved 2,63 A; og Cu-Cu-avstanden er 2,95 A..
Nomenklatur
- Kobber (II) hydroksid.
- Kobberhydroksid.
- Kobberdihydroksid.
Eiendommer
Fysisk tilstand
Krystallinsk fast stoff.
Molekylær vekt
99,58 g / mol.
Smeltepunkt
Den nedbrytes før smelting. Nedbrytningspunkt 229 ºC.
Tetthet
3,37 g / cm3
Løselighet
Det er praktisk talt uoppløselig i vann: 2,9 mikrogram / l ved 25 ° C. Raskt løselig i syrer, i konsentrerte alkaliske oppløsninger og i ammoniumhydroksid. Uoppløselig i organiske løsningsmidler. I varmt vann spaltes det og genererer kobber (II) oksid, som er mer stabilt.
Andre egenskaper
Den er lett løselig i sterke syrer og også i konsentrerte alkaliske hydroksydløsninger for å gi dype blå anioner, sannsynligvis av [Cun(ÅH)2n + 2]to-.
Dens stabilitet avhenger av tilberedningsmetoden.
Det kan spaltes og gi svart kobber (II) oksid (CuO) hvis det forblir i ro i noen dager eller under oppvarming.
I nærvær av et overskudd av alkali nedbrytes det over 50 ° C.
applikasjoner
I landbruket
Kobber (II) hydroksid har en bred anvendelse som soppdrepende middel og antibakteriell i landbruksavlinger. Her er noen eksempler:
- Det virker mot bakterielle flekker (av Erwinia) på salat, påføres som en bladbehandling.
- Mot bakterielle flekker (av Xanthomonas pruni) i fersken, som det brukes en sovende og bladbehandling.
- Det brukes mot blad- og stammedyr av blåbær gjennom latente applikasjoner.
- Mot råte under lagring av blåbær forårsaket av Monilinia oxycocci, etter latent søknad.
For anvendelse i landbruket brukes kobber (II) hydroksid, som fremstilles i nærvær av fosfater på grunn av den lille partikkelstørrelsen..

I bevaring av tre
Tre, som er organisk i naturen, er følsomt for angrep fra insekter og mikroorganismer. Kobber (II) hydroksid brukes som et biocid for sopp som angriper tre.
Det brukes vanligvis i forbindelse med en kvartær ammoniumforbindelse (NH4+). Kobberhydroksidet fungerer som et soppdrepende middel, og den kvartære ammoniumforbindelsen fungerer som et insektmiddel..
På denne måten tåler eller motstår det behandlede treet serviceforholdene og når det ytelsesnivået som kreves av brukeren. Tre som er behandlet med disse forbindelsene har imidlertid et høyt nivå av kobber og er veldig etsende for vanlig stål, så det kreves en type rustfritt stål som tåler behandlingen av behandlet tre..
Til tross for sin nytte, anses kobber (II) hydroksid som et litt farlig biocid.
Av denne grunn er det bekymring for at det vil slippes ut fra behandlet trevirke i miljøet i mengder som kan være skadelige for mikroorganismer som er naturlig tilstede i vann (elver, innsjøer, våtmark og sjø) eller jorda..
Ved produksjon av rayon
Siden 1800-tallet har ammoniakkløsninger av kobber (II) hydroksid blitt brukt for å oppløse cellulose. Dette er et av de første trinnene for å skaffe fiber som kalles rayon ved hjelp av teknologien utviklet av Bemberg i Tyskland..
Kobber (II) hydroksid oppløses i en løsning av ammoniakk (NH3), og danner et komplekst salt.
De raffinerte korte bomullsfibrene tilsettes kobberammoniakkløsningen som inneholder kobber (II) hydroksyd som et utfelt fast stoff..
Bomullscellulose danner et kompleks med kobbertetraammoniumhydroksyd oppløst i løsningen.
Denne løsningen blir deretter koagulert mens den føres gjennom en ekstruderingsanordning..
På grunn av de høye kostnadene har denne teknologien allerede blitt overgått av viskose. Bemberg-teknologi brukes for tiden bare i Japan.
I dyrefôrindustrien
Det brukes som spor i dyrefôr, ettersom det er et av stoffene som kreves som mikronæringsstoffer for full ernæring av dyr.

Dette er fordi i høyere levende vesener er kobber et essensielt element, som kreves for aktiviteten til en rekke kobberholdige enzymer..
For eksempel er det inneholdt i enzymet som deltar i produksjonen av kollagen og i enzymet som kreves for syntese av melanin, blant andre.
Det er en forbindelse som generelt er kjent som trygt når den tilsettes i nivåer som samsvarer med god spisepraksis..

Ved fremstilling av andre kobber (II) forbindelser
Aktiv forløper i produksjonen av følgende kobber (II) forbindelser: kobber (II) naftenat, kobber (II) 2-etylheksanoat og kobbersåper. I disse tilfellene brukes kobber (II) hydroksyd, som syntetiseres i nærvær av ammoniakk..
Andre bruksområder
Den brukes i stabilisering av nylon, i batterielektroder; som fargefikser i farging; som et pigment; i insektmidler; i behandling og farging av papir; i katalysatorer, som en katalysator ved vulkanisering av polysulfidgummi; som et bunnstoffpigment; og i elektrolyse, i galvanisering.
Fremtidige medisinske applikasjoner
Kobber (II) hydroksyd er en del av kobberforbindelsene som studeres i form av nanopartikler for eliminering av bakterier som E coli, K. pneumoniae, P. aeruginosa, Salmonella spp., blant annet forårsaker sykdommer hos mennesker.
Det har også blitt funnet at nanopartikler av kobber kan være effektive mot Candida albicans, en sopp som er en vanlig årsak til menneskelige patologier.
Dette indikerer at kobbernanoteknologi kan spille en viktig rolle mot bakterier og sopp som forårsaker infeksjoner hos mennesker, og kobber (II) hydroksid kan være veldig nyttig i disse feltene..
Referanser
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volum 7. Fjerde utgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A7. VCH Verlagsgesellschaft mbH.
- Bailar, J.C.; Emeléus, H.J.; Sir Ronald Nyholm og Trotman-Dickenson, A.F. (1973). Omfattende uorganisk kjemi. Volum 3. Pergamon Press.
- National Library of Medicine. (2019). Kobber (II) hydroksyd. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Schiopu, N. og Tiruta-Barna, L. (2012). Trebeskyttelsesmidler. I toksisitet for byggematerialer. Kapittel 6. Gjenopprettet fra sciencedirect.com.
- Mordorski, B. og Friedman, A. (2017). Metall nanopartikler for mikrobiell infeksjon. I funksjonaliserte nanomaterialer for behandling av mikrobiell infeksjon. Kapittel 4. Gjenopprettet fra sciencedirect.com.
- Takashi Tsurumi. (1994). Løsningen snurrer. Avansert fiber spinning teknologi. Kapittel 3. Gjenopprettet fra sciencedirect.com.


Ingen har kommentert denne artikkelen ennå.