
Jern (II) hydroksydstruktur, egenskaper, bruksområder
De jern (II) hydroksid, også kalt jernhydroksid, det er en uorganisk forbindelse med den kjemiske formelen Fe (OH)to. Hvis renheten din er høy, består det faste stoffet bare av Fe-ionerto+ og OH- i forholdet 2: 1; det kan imidlertid inneholde vannmolekyler og forskjellige ioniske arter, og endre posisjonen.
Den representerer den “reduserte” formen av den berømte rusten, en rødaktig overflate som består av Fe-ioner.3+; mens den er i grønn rust, dominerer Feto+, ved siden av OH- og annen mengde anioner: CO3to-, SW4to-, IKKE3- og halogenider (F-, Cl-,… ), for eksempel. Resultatet, selv om basen til denne grønne rusten er Fe (OH)to, er at forskjellige faste stoffer oppnås.

I hverdagen kan dette hydroksidet sees på vanlige steder. For eksempel har båten på bildet over overflaten dekket av grønn rust (ikke patina). Det er troen (OH)to, men ledsaget av mange ioner fra havets bølger.
Kjemisk sett avhenger egenskapene og bruken av dette materialet av Fe kation.to+ og dens tendens til å oksidere til å bli Fe3+. Det er et reduksjonsmiddel som reagerer raskt med oksygen under grunnleggende forhold. Derfor må den brukes i inerte atmosfærer og i syreoppløsninger..
Artikkelindeks
- 1 Struktur av jern (II) hydroksid
- 1.1 Koblinger
- 1.2 Dobbeltlag med hydroksid
- 1.3 Hydrater
- 1.4 Grønn og rød rust
- 2 eiendommer
- 3 bruksområder
- 3.1 Kvalitativ organisk analyse
- 3.2 Selenoksydreduksjonsmiddel
- 3.3 Dobbeltlagsmaterialer
- 4 Referanser
Struktur av jern (II) hydroksid
Lenker
Vurderer bare Fe (OH)to ren, har ingenting annet enn Fe-ionerto+ og OH-.
Samspillet mellom dem må i teorien være ionisk; hvert Fe kationto+ tiltrekker seg to OH-anioner-, hvis ikke-retningsbestemte attraksjoner ender med å etablere en strukturell og repeterende orden som definerer en krystall; som igjen gir opphav til grønt ruststøv.
Problemet er at det er en viss kovalent karakter mellom begge ioner, og derfor kan en ionisk Fe-OH-binding ikke ignoreres. Med tanke på en delvis ionisk Fe-OH-binding, kan det forstås at de er gruppert i et slags polymert lag.
Dobbeltlag med hydroksid
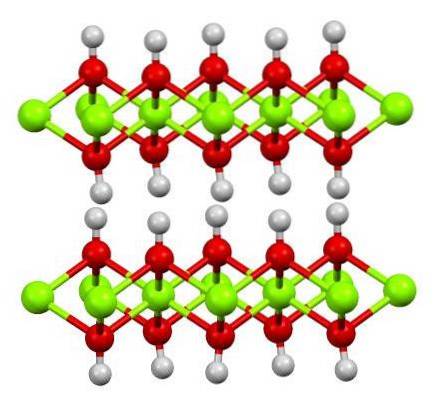
Strukturen av rent jernholdig hydroksyd er vist ovenfor med en ball-and-stick-modell. Fe-kationeneto+ er representert av de lysegrønne kulene, mens OH-anionene- av de røde og hvite kulene. Legg merke til hvordan Fe-ionene stemmer overensto+ takket være interaksjonene (ionisk-kovalent) med OH-.
Hvorfor kalles denne strukturen doble hydroksydlag? Selve bildet gir svaret: det er to rader eller lag med OH- for hver av Troto+; det vil si at forholdet 2: 1 Fe (OH) opprettholdesto nevnt i begynnelsen.
Strukturelle enheter for Fe (OH)to er da disse smørbrødene, hvor lagene av OH- de ville komme for å representere brødene; negativt ladede brød som derfor ikke klarer å sette seg ordentlig for å definere en slående brun krystall.
Men på den annen side stiller H-atomene seg også opp og overskygger hverandre. Når man husker begrepet polaritet og elektronegativitet, har disse hydrogenene en liten positiv delvis ladning, δ +; som, selv om de er svake, kan ha en positiv sone der andre anioner eller molekyler er plassert.
Hydrater
Når Fe (OH)to oppløses i vann, dets molekyler koordinerer med metallsenteret til Feto+ for å danne et kompleks vandig: [Fe (HtoELLER)4(ÅH)to]. Dette komplekset har en oktaedrisk geometri fordi den har seks ligander: fire vannmolekyler og to OH-molekyler.-. Imidlertid, i hydrert jernholdig hydroksyd, er bildet litt annerledes..
I hydratet, av den hypotetiske formelen Fe (OH)toNHtoEller vannmolekylene ligger nøyaktig mellom de to lagene av hydroksid; det vil si at de samhandler gjennom dipolionkrefter med hydrogener eller hvite kuler. Det er som om to OHFeOH-smørbrød ble tatt og vann ble satt inn for å gruppere dem: OHFeOH (HtoO) OHFeOH.
Vannmolekylene er veldig dynamiske, og forhindrer at hydratpartiklene får betydelige størrelser, og de danner følgelig et kolloidalt eller gelatinøst fast stoff..
Grønn og rød rust
I hydrater har hydroksydlagene hverandre vannmolekyler; de kan imidlertid ha andre anioner (allerede nevnt), og forårsaker et bredt utvalg av grønne rust. På samme måte kan de til og med "fange" molekyler så store som DNA, eller medisiner.
Ikke bare kan Fe-ioner være til stedeto+, men også tro3+, produkt av intern oksidasjon forårsaket av interkalert oksygen. Det vil synlig observeres at den grønne rusten (eller oksidet) begynner å bli rødlig når konsentrasjonen av Fe øker.3+.
Eiendommer

Fe (OH) vist ovenforto utfelt i et prøverør. Å være i rikelig med vann, bør kompleks vandig dominere over den nettopp nevnte strukturen. Vær oppmerksom på at overflaten viser en oransje farge, et produkt av oksydasjonen av Feto+ til tro3+ av oksygen i luften; dette hydroksidet er et reduksjonsmiddel:
Troto+ <=> Tro3+ + og-
Det fysiske utseendet til denne forbindelsen i ren tilstand er et brunt fast stoff:

Som, avhengig av fuktighetsnivået, kan fremstå som et geléaktig grønt fast stoff. Det er ganske uoppløselig i vann (Ksp= 8 10-16 og løselighet = 0,72 g / 100 ml ved 25 ° C), og har en molær masse på 89,86 g / mol og en tetthet på 3,4 g / ml.
Ingen kokepunkter eller smeltepunkter er rapportert for denne forbindelsen; sannsynligvis på grunn av det at det før en varmekilde dehydrerer og omdannes til jernholdig oksid, FeO:
Fe (OH)to => FeO + HtoELLER
applikasjoner
Kvalitativ organisk analyse
Dens reduserende effekt brukes til å bestemme tilstedeværelsen av nitroforbindelser, RNOto. Reaksjonen som det oppnås en positiv test for, er representert ved følgende kjemiske ligning:
RNOto + 6Fe (OH)to + 4HtoO => RNHto + 6Fe (OH)3
Fe (OH)3 utfeller som et rødbrunt fast stoff, som sertifiserer tilstedeværelsen av nitrogruppen, -NOto.
Selen oksoanion redusering
Den reduserende kraften til Fe (OH)to den har også blitt brukt til å redusere SeO-anioner3to- (selenitt) og SeO4to- (selenat) til elementært selen, Se. Det tillater praktisk talt fjerning av slike helseskadelige anioner i form av et uoppløselig og lett ekstraherbart selenfast stoff.
Dobbeltlagsmaterialer
Den rene strukturen og den grønne rusten er en kilde til inspirasjon for design av nye materialer med mineralogiske egenskaper..
Det anslås at deres funksjon er å tillate transport av en bestemt art mellom lagene på en slik måte at frigjøringen til det aktive stedet (jord, celler, metalloverflate, etc.) kan kontrolleres eller reduseres..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Jern (II) hydroksid. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. (2019). Jernholdig hydroksid. PubChem-database. CID = 10129897. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Nick Doe. (s.f.). Tester for fenoler og nitrogrupper. Kjemi 211. Gjenopprettet fra: academics.wellesley.edu
- Clark Jim. (27. april 2019). Kjemi av jern. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Kingston teknisk programvare. (2019). Rustkjemi. Korrosjons leger. Gjenopprettet fra: corrosion-doctors.org
- Zingaro, Ralph A. et al. (1997). Reduksjon av oksoselenanioner med jern (II) hydroksid. Miljø internasjonalt. 23 (3): 299-304. doi: 10.1016 / S0160-4120 (97) 00032-9



Ingen har kommentert denne artikkelen ennå.