
Kvikksølvhydroksydstruktur, egenskaper, bruksområder, risiko

De kvikksølvhydroksid Det er en uorganisk forbindelse der metall kvikksølv (Hg) har et oksidasjonsnummer på 2+. Dens kjemiske formel er Hg (OH)to. Imidlertid har denne arten ennå ikke blitt oppnådd i fast form under normale forhold..
Kvikksølvhydroksid eller kvikksølvhydroksyd er et kortvarig forbigående mellomprodukt i dannelsen av kvikksølvoksid HgO i alkalisk løsning. Fra studier utført i løsninger av kvikksølvoksid HgO, er det utledet at Hg (OH)to det er en svak base. Andre arter som følger med det er HgOH+ og Hgto+.

Til tross for at vi ikke kan bli utfelt i vandig løsning, Hg (OH)to Det er oppnådd ved fotokjemisk reaksjon av kvikksølv med hydrogen og oksygen ved svært lave temperaturer. Det er også oppnådd i form av et samutfelling sammen med Fe (OH)3, hvor tilstedeværelsen av halogenidioner påvirker pH ved hvilken co-utfelling forekommer.
Siden det ikke lett har blitt oppnådd rent på laboratorienivå, har det ikke vært mulig å finne noen bruk for denne forbindelsen, og heller ikke å bestemme risikoen for bruken. Det kan imidlertid utledes at den utgjør de samme risikoene som de andre kvikksølvforbindelsene.
Artikkelindeks
- 1 Molekylets struktur
- 2 Elektronisk konfigurasjon
- 3 Nomenklatur
- 4 eiendommer
- 4.1 Molekylvekt
- 4.2 Kjemiske egenskaper
- 5 Motta
- 5.1 Rent kvikksølvhydroksid
- 5.2 Samutfelling med jern (III) hydroksid
- 6 bruksområder
- 7 Nyere studier
- 8 Risiko
- 9 Referanser
Molekylets struktur
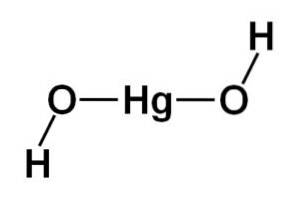
Strukturen av kvikksølv (II) hydroksid Hg (OH)to den er basert på en lineær sentral del dannet av kvikksølvatomet med de to oksygenatomene på sidene.
Hydrogenatomer er festet til denne sentrale strukturen, hver ved siden av hvert oksygen, som roterer fritt rundt hvert oksygen. Det kan vises på en enkel måte som følger:
Elektronisk konfigurasjon
Den elektroniske strukturen til metallisk kvikksølv Hg er som følger:
[Xe] 5d10 6sto
hvor [Xe] er elektronkonfigurasjonen til edelgass-xenon.
Når man observerer denne elektroniske strukturen, blir det avledet at den mest stabile oksidasjonstilstanden for kvikksølv er den der de to elektronene i lag 6 går tapt.s.
I kvikksølvhydroksyd Hg (OH)to, kvikksølvatomet (Hg) er i 2+ oksidasjonstilstand. Derfor, i Hg (OH)to kvikksølv har følgende elektroniske konfigurasjon:
[Xe] 5d10
Nomenklatur
- Kvikksølv (II) hydroksid
- Merkurhydroksid
- Kvikksølv dihydroksid
Eiendommer
Molekylær vekt
236,62 g / mol
Kjemiske egenskaper
I følge informasjonen som er konsultert, er det mulig at Hg (OH)to være en forbigående forbindelse i dannelsen av HgO i alkalisk vandig medium.
Tilsetningen av hydroksylioner (OH-) til en vandig løsning av kvikksølvioner Hgto+ fører til utfelling av et gult faststoff av kvikksølv (II) oksid HgO, hvorav Hg (OH)to er midlertidig eller midlertidig agent.

I vandig løsning Hg (OH)to Det er et veldig kortvarig mellomprodukt, da det raskt frigjør et vannmolekyl og fast HgO-utfelling.
Selv om det ikke har vært mulig å felle ut kvikksølvhydroksid Hg (OH)to, kvikksølv (II) oksid HgO er noe løselig i vann og danner en løsning av arter som kalles "hydroksider".
Disse artene i vann som kalles "hydroksider" er svake baser, og selv om de noen ganger oppfører seg som amfotere, generelt Hg (OH)to den er mer basisk enn syre.
Når HgO oppløses i HClO4 studier indikerer tilstedeværelsen av kvikksølvion Hgto+, et monohydroksymerkurisk ion HgOH+ og kvikksølvhydroksyd Hg (OH)to.
Likevektene som oppstår i slike vandige oppløsninger er som følger:
Hgto+ + HtoO ⇔ HgOH+ + H+
HgOH+ + HtoO ⇔ Hg (OH)to + H+
I alkaliske oppløsninger av NaOH dannes arten Hg (OH)3-.
Å skaffe
Rent kvikksølvhydroksid
Kvikksølv (II) hydroksid Hg (OH)to Det kan ikke oppnås i vandig oppløsning, fordi når man tilsetter alkali til en løsning av kvikksølvioner Hgto+, gul kvikksølvoksid HgO utfelles.
Noen forskere klarte imidlertid å skaffe kvikksølvhydroksid Hg (OH) for første gang i 2005to ved hjelp av en kvikksølvbuelys, med utgangspunkt i elementet kvikksølv Hg, hydrogen Hto og oksygen Oto.

Reaksjonen er fotokjemisk og ble utført i nærvær av fast neon, argon eller deuterium ved svært lave temperaturer (rundt 5 K = 5 grader Kelvin). Bevis for dannelse av forbindelser ble oppnådd ved hjelp av IR (infrarød) lysabsorpsjonsspektre.
Hg (OH)to forberedt på denne måten er det veldig stabilt under erfaringsforholdene. Det anslås at den fotokjemiske reaksjonen fortsetter gjennom det mellomliggende O-Hg-O til det stabile molekylet H-O-Hg-O-H.
Samutfelling med jern (III) hydroksid
Hvis kvikksølv (II) sulfat HgSO oppløses4 og jern (III) sulfat Feto(SW4)3 i sur vandig oppløsning, og pH begynner å øke ved å tilsette en løsning av natriumhydroksyd NaOH, etter stående tid dannes et fast stoff som er utledet til å være et bunnfall av Hg (OH)to og Fe (OH)3.
Det er funnet at dannelsen av Hg (OH)to er et kritisk trinn i denne samutfellingen med Fe (OH)3.
Dannelsen av Hg (OH)to i bunnfallet Fe (OH)3-Hg (OH)to avhenger sterkt av tilstedeværelsen av ioner som fluor, klorid eller bromid, av deres spesifikke konsentrasjon og av pH i løsningen.
I nærvær av fluor (F-), ved pH større enn 5, samutfelling av Hg (OH)to med Fe (OH)3 det påvirkes ikke. Men ved en pH på 4 dannes dannelsen av komplekser mellom Hgto+ og F- forstyrrer samutfellingen av Hg (OH)to.
I tilfelle tilstedeværelse av klorid (Cl-), samutfellingen av Hg (OH)to forekommer ved en pH på 7 eller høyere, dvs. fortrinnsvis i et alkalisk medium.
Når bromid (Br-), samutfellingen av Hg (OH)to forekommer ved enda høyere pH, det vil si pH over 8,5, eller mer alkalisk enn med klorid.
applikasjoner
Fra gjennomgangen av tilgjengelige kilder er det utledet at kvikksølv (II) hydroksid Hg (OH)to, Å være en forbindelse som ennå ikke er tilberedt kommersielt, har den ingen kjente bruksområder.
Nylige studier
Ved hjelp av beregningssimuleringsteknikker i 2013 ble de strukturelle og energiske egenskapene relatert til hydrering av Hg (OH) studert.to i gassform.
Metall-ligand koordinering og oppløsningsenergier ble beregnet og sammenlignet ved å variere graden av hydrering av Hg (OH)to.
Blant annet ble det funnet at tilsynelatende er den teoretiske oksidasjonstilstanden 1+ i stedet for den antatte 2+ som vanligvis er tildelt Hg (OH)to.
Risiko
Selv om Hg (OH)to som sådan har den ikke blitt isolert i tilstrekkelig mengde og derfor ikke blitt brukt kommersielt, dens spesifikke risikoer er ikke bestemt, men det kan utledes at den utgjør samme risiko som resten av kvikksølvsalter.
Det kan være giftig for nervesystemet, fordøyelsessystemet, huden, øynene, luftveiene og nyrene..
Innånding, svelging eller kontakt med huden av kvikksølvforbindelser kan forårsake skade som spenner fra øye- og hudirritasjon, søvnløshet, hodepine, skjelving, skade på tarmkanalen, hukommelsestap, til nyresvikt, blant andre symptomer.
Kvikksølv er internasjonalt anerkjent som et forurensende stoff. De fleste kvikksølvforbindelser som kommer i kontakt med miljøet blir metylert av bakterier som er tilstede i jord og sedimenter, og danner metylkviksølv.
Denne forbindelsen bioakkumuleres i levende organismer, som går fra jord til planter og derfra til dyr. I vannmiljøet er overføringen enda raskere, og går fra veldig små til store arter på kort tid.
Metylkvikksølv har en toksisk effekt for levende vesener og spesielt for mennesker som inntar det gjennom næringskjeden.
Når det inntas med mat, er det spesielt skadelig for små barn og fostre hos gravide kvinner, siden det er et nevrotoksin, kan det skade hjernen og nervesystemet i dannelse og vekst..
Referanser
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Wang, Xuefeng og Andrews, Lester (2005). Infrarødt spektrum av Hg (OH)to i Solid Neon og Argon. Uorganisk kjemi, 2005, 44, 108-113. Gjenopprettet fra pubs.acs.org.
- Amaro-Estrada, J.I., et al. (2013). Aqueous Solvation of Hg (OH)to: Energetiske og dynamiske tetthetsfunksjonelle teoristudier av Hg (OH)to-(HtoELLER)n (n = 1-24) Strukturer. J. Phys. Chem. A 2013, 117, 9069-9075. Gjenopprettet fra pubs.acs.org.
- Inoue, Yoshikazu og Munemori, Makoto. (1979). Samutfelling av kvikksølv (II) med jern (III) hydroksid. Miljøvitenskap og teknologi. Volum 13, nummer 4, april 1979. Gjenopprettet fra pubs.acs.org.
- Chang, L.W., et al. (2010). Nervesystemet og atferdstoksikologi. I omfattende toksikologi. Gjenopprettet fra sciencedirect.com.
- Haney, Alan og Lipsey, Richard L. (1973). Akkumulering og effekter av metyl kvikksølvhydroksid i en jordbasert næringskjede under laboratorieforhold. Miljø. Forurense. (5) (1973) s. 305-316. Gjenopprettet fra sciencedirect.com.



Ingen har kommentert denne artikkelen ennå.