
Immunoglobulin D struktur, funksjon og normale verdier

De immunoglobulin D (IgD), oppdaget i 1965, er et overflateimmunoglobulin som finnes (sammen med IgM) i membranen til B-lymfocytter (mIgD) før aktivering.
Det har sin funksjon som den første reseptoren for antigener. IgD er også fritt i plasma takket være dets sekresjon (sIgD). Den har en molekylvekt på 185.000 Dalton og representerer omtrent 1% av immunglobuliner i en organisme.
Artikkelindeks
- 1 Hva er immunglobuliner?
- 2 Struktur
- 3 Funksjon og sykdommer
- 3.1 sIgD
- 3,2 mIgD
- 3,3 B lymfocytter
- 3.4 Immun-inflammatorisk system
- 4 Normale verdier
- 4.1 Serumkonsentrasjon
- 4.2 Blodverdier
- 5 Referanser
Hva er immunglobuliner?
Immunglobuliner eller antistoffer er svært spesifikke komplekse kuleformede glykoproteiner syntetisert av B-lymfocytter, celler som er ansvarlige for immunresponsen i dyrenes kropp..
Immunoglobuliner samhandler med molekyler som kroppen identifiserer som ikke-selv eller antigener. Ethvert stoff som er i stand til å aktivere immunresponsen i kroppen kalles et antigen..
Familien av Ig-antistoffmolekyler inkluderer de som sirkulerer i blodplasma og de på overflaten av B-lymfocytter før aktivering..
Det er fem typer immunglobuliner: IgG, IgD, IgE, IgA og IgM (identifisert hos mennesker, mus, hunder, reptiler, fisk, blant andre), som skiller seg strukturelt av deres konstante regioner i den tunge kjeden. Disse forskjellene gir dem spesielle funksjonelle egenskaper.
Antistoffer fungerer som spesifikke sensorer for antigener. Med disse danner de komplekser som initierer en kaskade av reaksjoner som er typiske for immunforsvaret. De generelle stadiene i denne prosessen er: gjenkjenning, differensiering av spesifikke lymfocytter og til slutt effektorstadiet.
Struktur
Alle antistoffer er komplekse polypeptidmolekyler formet som et "Y". De består av fire polypeptidkjeder, to av dem identiske lette (korte) kjeder med ca. 214 aminosyrer hver, og de andre to tunge (lange) kjedene også identiske med hverandre, dobbelt så mange aminosyrer. En disulfidbinding knytter en lett kjede til en tung kjede.
Begge typer kjeder har konstante regioner (karakteristisk for typen antistoff og arten som organismen tilhører), der sekvensen av aminosyrer gjentas fra ett molekyl til et annet, og de har også variable regioner på omtrent 100 aminosyrer i lengde..
En disulfidbro (kovalent type binding) forbinder hver lette kjede med en tung kjede, og i sin tur kan en eller to av disse bindingene bli sammen med de to tunge kjedene.
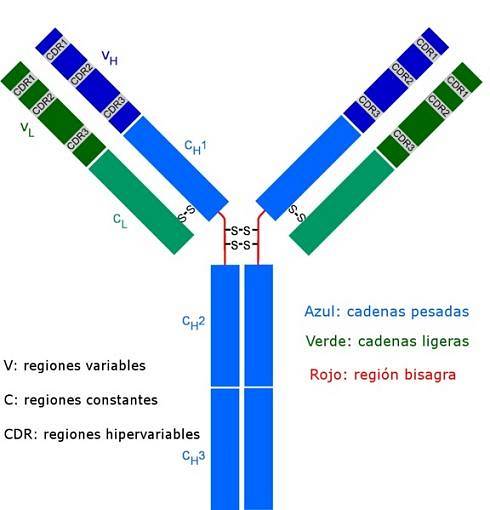
Disse stedene er de som binder som en hanske til en bestemt region av det spesifikke antigenet, epitopen eller den antigene determinanten. Stabiliseringen av denne interaksjonen skjer takket være mange ikke-kovalente bindinger.
Disse CDR-sekvensene er svært varierende blant antistoffer, og genererer spesifisitet for forskjellige typer antigener..
Når det gjelder egenskapene til immunoglobulin D, er det kjent at det presenterer et stort mangfold blant virveldyr. Generelt sett består den av to delta tunge kjeder og to lette kjeder. IgD er enten fritt i serum eller bundet til B-lymfocytter gjennom en Fc-reseptor..
Funksjon og sykdommer
Siden IgD evolusjonært er bevart fra bruskfisk (som befolket planeten for rundt 500 millioner år siden) til mennesker, antas det å tjene viktige immunfunksjoner.
Til tross for dette har det vært den minst studerte av immunglobuliner, for hvilke de spesifikke funksjonene til sIgD i serum ennå ikke er kjent nøyaktig, mens flere funksjoner er blitt foreslått for mIgD.
sIgD
En av årsakene til den nylige interessen for studien av sIgD har vært funnet av høye nivåer av denne Ig hos noen barn med periodisk feber. I sin tur er en annen faktor av interesse dens nytte for å overvåke myelomer..
SIgD antas å spille en rolle i blodet, slimhinnesekresjonene og på overflaten av medfødte immuneffektorceller, slik som basofiler.
De er svært reaktive mot patogener i luftveiene og deres utskillelsesprodukter. IgD har blitt rapportert å øke slimhinneimmuniteten takket være dens effekt på tilstedeværende bakterier og virus.
mygD
Når det gjelder mIgD, regnes det som en membranantigenreseptor for B-lymfocytter, noe som vil favorisere cellemodning. I sin tur antas det å være en ligand for IgD-reseptorer i immunreguleringen av T-hjelperceller..
B-lymfocytter
Det antas at IgD-produserende B-lymfocytter representerer en bestemt cellelinje kalt B-1 lymfocytter. Dette er selvreaktive lymfocytter som har sluppet unna den klonale slettingen.
Autoantistoffene generert av disse lymfocyttene reagerer med deoksyribonukleinsyre eller DNA (enkelt- og dobbeltstrenget), med cellereseptorer, cellemembranene til røde blodlegemer og epitelvev..
Slik genererer de autoimmune sykdommer, for eksempel systemisk lupus erythematosus, myasthenia gravis, autoimmun hemolytisk anemi og idiopatisk trombocytopeni purpura.
Immun-inflammatorisk system
Det er også kjent at IgD er involvert i orkestrering av et system som forstyrrer immunforsvaret og inflammatoriske systemer: høye konsentrasjoner av IgD er relatert til autoinflammatoriske lidelser (hyperimmunoglobulemia syndrom D, HIDS eller hyper-IgD).
For eksempel, hos pasienter med autoimmune tilstander, slik som revmatoid artritt, er forhøyede verdier av både sIgD og mIgD funnet. Det antas derfor at denne tilstanden bidrar til sykdommens patogenese.
De mulige funksjonene til dette antistoffet i perifere mononukleære blodceller (PBMC) fra disse pasientene blir for tiden studert. Alt dette har ført til å vurdere at IgD kan være et potensielt immunterapeutisk mål for behandling av revmatoid artritt..
Normale verdier
SIgD hos normale individer varierer mye, noe som har gjort det vanskelig å etablere et nøyaktig referanseintervall for deres normale konsentrasjoner. Noen studier har vist at denne variasjonen er spesielt påvirket av:
- Følsomheten til den anvendte deteksjonsteknikken - både ved radioimmunoanalyser (RIA), enzymimmunoanalyser (EIA) og den mest brukte i kliniske laboratorier som er radioimmunodiffusjon (RID)-.
- Fraværet av en enkelt bestemt universell metode for påvisning av IgD.
- Arvelige faktorer, rase, alder, kjønn, graviditetsstatus, røykestatus, blant andre
Noen spesialister anser til og med at rutineanalysen av IgD ikke er berettiget, fordi dens spesifikke rolle langt fra er belyst, og kostnadene ved analysen i det kliniske laboratoriet er høye. Det ville bare være berettiget i tilfeller av pasienter med monoklonalt serum IgD eller mistenkt for å ha HIDS.
Serumkonsentrasjon
På den annen side er det kjent at sIgD generelt har en serumkonsentrasjon lavere enn den for IgG, IgA og IgM, men høyere enn konsentrasjonen av IgE..
Videre, fordi den har en halveringstid på 2 til 3 dager, er plasmakonsentrasjonen mindre enn 1% av det totale immunglobulinet i serum. Noen undersøkelser indikerer at det representerer 0,25% av totalt serumimmunglobuliner.
Blodverdier
Blant de rapporterte verdiene av sIgD i blod har det hos nyfødte vært 0,08 mg / l (bestemt av RIA), hos spedbarn og voksne varierer det fra uoppdagelige verdier til 400 mg / L (avhengig av alder og individer for hver individuell).
Hos normale voksne har de blitt rapportert som normale gjennomsnitt 25; 35; 40 og 50 mg / L. Generelt er gjennomsnittlig serumkonsentrasjon for friske voksne rapportert som 30 mg / L (bestemt av RID)..
Imidlertid, som diskutert i denne artikkelen, er det mange faktorer som forhindrer å etablere en rekke standard normale verdier..
Referanser
- Chen, K. og Cerutti, A. (2011). Funksjonen og reguleringen av immunglobulin D. Nåværende mening i immunologi, 23 (3), 345-52.
- Harfi, A. H. og Godwin, J.T. (1985). Normale serumnivåer av IgG, IgA, IgM, IgD og IgE i Saudi-Arabia. Annals of Saudi Medicine, bind 5, nr. 2.99-104. doi: 10.5144 / 0256-4947.1985.99
- Josephs, S.H. og Buckley, R.H. (1980). Serum IgD-konsentrasjoner hos normale spedbarn, barn og voksne og hos pasienter med forhøyet IgE. The Journal of Pediatrics, Vol. 96, nr. 3, s. 417-420.
- Vladutiu, A.O. (2000). Immunoglobulin D: egenskaper, måling og klinisk relevans. Klinisk og diagnostisk laboratorieimmunologi, 7(2), 131-40.
- Voet, J.G. og Voet, W.P.D. (2005). Fundamentals of Biochemestry: Lyfe på molekylært nivå. Wiley. s. 1361.
- Wu, Y., Chen, W., Chen, H., Zhang, L., Chang, Y., Yan, S., Dai, X., Ma, Y., Huang, Q. og Wei, W. ( 2016). Det forhøyede utskilte immunglobulin D forbedret aktiveringen av perifere mononukleære blodceller i revmatoid artritt. PloS one, 11 (1). doi: 10.1371 / journal.pone.0147788


Ingen har kommentert denne artikkelen ennå.