
Isobar-egenskaper, eksempler og forskjeller med isotoper

De isobarer De er de atomartene som har samme masse, men som kommer fra forskjellige kjemiske elementer. Som en konsekvens av dette kan det sies at de består av forskjellige antall protoner og nøytroner.
Både protoner og nøytroner er i kjernen til atomene sine, men netto antall nøytroner og protoner som er tilstede i hver kjerne forblir den samme. Med andre ord stammer en isobar art når et par atomkjerner viser det samme netto antall nøytroner og protoner for hver art..
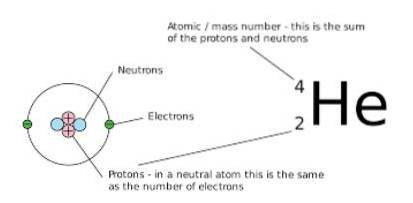
Imidlertid er antall nøytroner og protoner som utgjør nettomengden forskjellig. En måte å merke det grafisk på er å observere massetallet (som er plassert øverst til venstre på symbolet for det kjemiske elementet som er representert), fordi i isobarer er dette tallet det samme.
Artikkelindeks
- 1 Funksjoner
- 1.1 Representasjon
- 2 Eksempler
- 3 Forskjeller mellom isobarer og isotoper
- 4 Referanser
Kjennetegn
For det første kommer etymologien til begrepet isobarus fra de greske ordene isos (som betyr "lik") og baros (som betyr "vekt"), som refererer til likevekten mellom begge kjerneartene.
Det skal bemerkes at isobarer har visse likheter med andre arter hvis kjerner har tilfeldigheter, for eksempel isotoner, som har samme antall nøytroner, men med forskjellige massetall og atomnummer, som par 1. 3C og 14Ikke 36S og 37Cl.
På den annen side er begrepet "nuklid" navnet som er laget til hvert av settene av nukleoner (strukturer som består av nøytroner og protoner) som kan dannes.
Slik at nuklider muligens er preget av antall nøytroner eller protoner, eller til og med av mengden energi som strukturen til deres konglomerering har..
På samme måte oppstår en datterkjerne etter β-forfallsprosessen, og dette er igjen en isobar av foreldrekjernen, fordi antall nukleoner som er tilstede i kjernen forblir uendret, i motsetning til hva som skjer ved forfall α.
Det er viktig å huske at forskjellige isobarer har forskjellige atomnumre, og bekrefter at de er forskjellige kjemiske elementer..
Representasjon
For å betegne de forskjellige nuklidene, brukes en spesifikk betegnelse, som kan representeres på to måter: den ene består i å plassere navnet på det kjemiske elementet etterfulgt av massetallet, som er knyttet til en bindestrek. For eksempel: nitrogen-14, hvis kjerne består av syv nøytroner og syv protoner.
Den andre måten å representere disse artene på er å plassere symbolet på det kjemiske elementet, foran et numerisk overskrift som angir massen til det aktuelle atomet, samt et numerisk underskrift som betegner atomnummeret, på følgende måte:
ZTILX
I dette uttrykket representerer X det kjemiske elementet i det aktuelle atomet, A er massetallet (resultatet av tilsetningen mellom antall nøytroner og protoner) og Z representerer atomnummeret (lik antall protoner i kjernen til atom).
Når disse nuklidene er representert, blir atomnummeret til atomet (Z) vanligvis utelatt fordi det ikke gir relevante tilleggsdata, så det blir ofte representert som TILX.
En måte å vise denne notasjonen er ved å ta det forrige eksemplet (nitrogen-14), som også er betegnet som 14N. Dette er notasjonen som brukes til isobarer.
Eksempler
Bruken av uttrykket "isobarer" for arter kjent som nuklider som har samme antall nukleoner (likt massetall) ble foreslått på slutten av 1910-tallet av den britiske kjemikeren Alfred Walter Stewart..
I denne ideen kan det observeres et eksempel på isobarer når det gjelder arten 14C og 14N: massetallet er lik 14, dette innebærer at antall protoner og nøytroner i begge arter er forskjellig.
Faktisk har dette karbonatomet et atomnummer som er lik 6, så det er 6 protoner i strukturen, og i sin tur har det 8 nøytroner i kjernen. Så massetallet er 14 (6 + 8 = 14).
For sin del har nitrogenatomet et atomnummer lik 7, så det består av 7 protoner, men det har også 7 nøytroner i kjernen. Massetallet er også 14 (7 + 7 = 14).
Du kan også finne en serie der alle atomene har et massetall lik 40; dette er tilfellet med isobarer: 40AC, 40K, 40Ar, 40Cl, og 40S.
Forskjeller mellom isobarer og isotoper
Som tidligere forklart beskriver nuklider de forskjellige klasser av atomkjerner som eksisterer, i henhold til antall protoner og nøytroner de har..
Blant disse typer nuklider er også isobarer og isotoper, som vil bli differensiert nedenfor.
Når det gjelder isobarer, som nevnt tidligere, har de samme antall nukleoner - det vil si samme antall masse - hvor antallet protoner som den ene arten er større enn den andre, stemmer overens med antall nøytroner. har underskudd, så summen er den samme. Atomnummeret er imidlertid annerledes.
I denne forstand kommer isobararter fra forskjellige kjemiske elementer, så de ligger i forskjellige rom i det periodiske systemet og har forskjellige egenskaper og spesifikke egenskaper..
På den annen side, når det gjelder isotoper, skjer det motsatte, siden de har samme atomnummer, men forskjellige massemengder; det vil si at de har samme antall protoner, men et annet antall nøytroner inne i deres atomkjerner..
I tillegg er isotoper atomarter som tilhører de samme elementene, så de ligger i samme rom i det periodiske systemet og har lignende egenskaper og egenskaper..
Referanser
- Wikipedia. (s.f.). Isobar (nuklid). Gjenopprettet fra en.wikipedia.org
- Britannica, E. (s.f.). Isobar. Hentet fra britannica.com
- Konya, J. og Nagy, N. M. (2018). Nukleær og radiokjemi. Gjenopprettet fra books.google.co.ve
- Energiutdanning. (s.f.). Isobar (kjernefysisk). Hentet fra energyeducation.ca
- Veiledervisning. (s.f.). Kjerner. Gjenopprettet fra physics.tutorvista.com



Ingen har kommentert denne artikkelen ennå.