
Molarmasse hvordan man beregner den, eksempler og løste øvelser
De molær masse er en intensiv egenskap av materie som knytter begrepet føflekk til massemålinger. Å være mer kortfattet, er det mengden masse som tilsvarer en mol stoff; det vil si hva et Avogadro-nummer "veier", (6.022 · 102. 3) av bestemte partikler.
Én mol av et hvilket som helst stoff vil inneholde samme antall partikler (ioner, molekyler, atomer, etc.); imidlertid vil massen variere fordi dens molekylære dimensjoner er definert av antall atomer og isotoper som utgjør dens struktur. Jo mer massivt atomet eller molekylet er, desto større er dets molare masse..
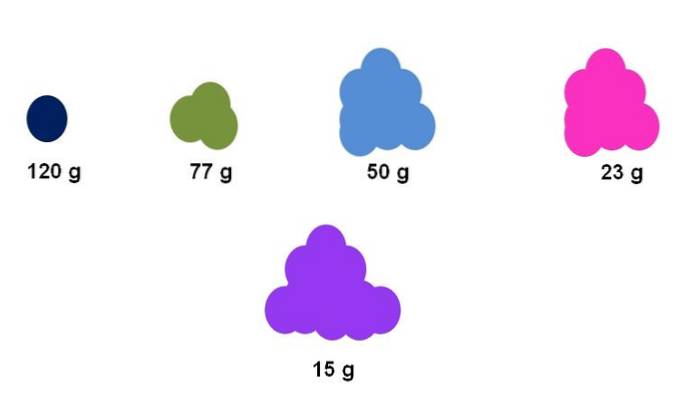
Anta for eksempel at det samles nøyaktig en mol for fem forskjellige forbindelser (toppbilde). Ved hjelp av en balanse er massen for hver klynge, uttrykt nedenfor, blitt målt. Denne massen tilsvarer molarmassen. Av alle har den lilla forbindelsen de letteste partiklene, mens den mørkeblå forbindelsen har de tyngste partiklene..
Vær oppmerksom på at en generalisert og overdrevet trend vises: jo høyere molarmasse, jo mindre blir mengden prøve som må plasseres på vekten. Imidlertid er dette volumet av materie også avhengig av tilstanden for aggregering av hver forbindelse og dens tetthet..
Artikkelindeks
- 1 Hvordan beregner du molarmassen?
- 1.1 Definisjon
- 1.2 Elementer
- 1.3 Forbindelser
- 2 Eksempler
- 3 Løst øvelser
- 3.1 Øvelse 1
- 3.2 Øvelse 2
- 3.3 Øvelse 3
- 4 Referanser
Hvordan beregner du molarmassen?

Definisjon
Molmasse kan beregnes ut fra definisjonen: mengde masse per mol stoff:
M = gram stoff / mol stoff
Faktisk er g / mol enheten der molær masse vanligvis uttrykkes, sammen med kg / mol. Dermed, hvis vi vet hvor mange mol vi har av en forbindelse eller et element, og vi veier det, vil vi komme direkte til molarmassen ved å bruke en enkel inndeling.
Elementer
Molær masse gjelder ikke bare forbindelser, men også for grunnstoffer. Begrepet føflekker diskriminerer ikke i det hele tatt. Derfor finner vi ved hjelp av et periodisk system de relative atommassene for et element av interesse, og vi multipliserer verdien med 1 g / mol; dette er Avogadros konstant, MELLER.
For eksempel er den relative atommassen til strontium 87,62. Hvis vi vil ha atommassen, vil den være 87,62 amu; men hvis det vi leter etter er dens molare masse, vil den være 87,62 g / mol (87,62 · 1g / mol). Og dermed oppnås molarmassene til alle de andre elementene på samme måte, uten å engang måtte utføre multiplikasjonen..
Forbindelser
Den molare massen til en forbindelse er ikke mer enn summen av de relative atommassene til atomene multiplisert med MELLER.
For eksempel vannmolekylet, HtoEller den har tre atomer: to hydrogen og ett oksygen. De relative atommassene til H og O er henholdsvis 1.008 og 15.999. Dermed legger vi til massene deres ved å multiplisere med antall atomer som er tilstede i forbindelsens molekyl:
2 H (1,008) = 2,016
1 O (15.999) = 15.999
M(HtoO) = (2016 + 15.999) 1g / mol = 18.015 g / mol
Det er en ganske vanlig praksis å utelate MELLER til slutt:
M(HtoO) = (2016 + 15.999) = 18.015 g / mol
Molarmasse forstås å ha enheter g / mol.
Eksempler
En av de mest kjente molarmassene har nettopp blitt nevnt: den til vann, 18 g / mol. De som er kjent med disse beregningene når et punkt der de er i stand til å huske noen molare masser uten å måtte lete etter dem eller beregne dem slik det ble gjort ovenfor. Noen av disse molare massene, som fungerer som eksempler, er følgende:
-ELLERto: 32 g / mol
-Nto: 28 g / mol
-NH3: 17 g / mol
-CH4: 16 g / mol
-COto: 44 g / mol
-HC1: 36,5 g / mol
-HtoSW4: 98 g / mol
-CH3COOH: 60 g / mol
-Fe: 56 g / mol
Merk at de gitte verdiene er avrundet. For mer presise formål bør molarmassene uttrykkes til flere desimaler og beregnes med de rette og nøyaktige relative atommassene.
Løst øvelser
Øvelse 1
Ved analysemetoder ble det anslått at en løsning av en prøve inneholder 0,0267 mol av en analyt D. Det er også kjent at dens masse tilsvarer 14% av en prøve hvis totale masse er 76 gram. Beregn molarmassen til den antatte analytten D..
Vi må bestemme massen av D som er oppløst i løsningen. Vi fortsetter:
Masse (D) = 76 g 0,14 = 10,64 g D
Det vil si at vi beregner 14% av 76 gram av prøven, som tilsvarer gram analyt D. Da, og til slutt, bruker vi definisjonen av molær masse, siden vi har nok data til å beregne den:
M(D) = 10,64 g D / 0,0267 mol D.
= 398,50 g / mol
Som oversettes med: en mol (6.022102. 3) av Y-molekyler har en masse lik 398,50 gram. Takket være denne verdien kan vi vite hvor mye av Y vi vil veie på vekten i tilfelle vi for eksempel ønsker å lage en løsning med en molar konsentrasjon på 5 · 10-3 M; det vil si oppløse 0.1993 gram Y i en liter løsningsmiddel:
5 10-3 (mol / L) · (398,50 g / mol) = 0,1993 g Y
Øvelse 2
Beregn molmassen av sitronsyre, vel vitende om at dens molekylformel er C6H8ELLER7.
Den samme formelen C6H8ELLER7 Det letter forståelsen av beregningen, siden den forteller oss med en gang antall C-, H- og O-atomer som er i sitronsyre. Derfor gjentar vi det samme trinnet som ble utført for vannet:
6 C · (12,0107) = 72,0642
8 H (1.008) = 8.064
7 O (15.999) = 111.993
M(sitronsyre) = 72,0642 + 8,064 + 111,993
= 192,1212 g / mol
Øvelse 3
Beregn molarmassen av kobbersulfatpentahydrat, CuSO45HtoELLER.
Vi vet fra før at molarmassen av vann er 18.015 g / mol. Dette hjelper oss med å forenkle beregningene, siden vi utelater det for øyeblikket og fokuserer på det vannfrie saltet CuSO4.
Vi har at de relative atommassene av kobber og svovel er henholdsvis 63,546 og 32,065. Med disse dataene fortsetter vi på samme måte som med øvelse 2:
1 Cu (63,546) = 63,546
1 S (32 065) = 32 065
4 O (15.999) = 63.996
M(CuSO4) = 63,546 + 32,065 + 63,996
= 159,607 g / mol
Men vi er interessert i molmassen til det pentahydrerte saltet, ikke det vannfrie. For å gjøre dette må vi legge til den tilsvarende vannmassen i resultatet:
5 timertoO = 5 (18,015) = 90,075
M(CuSO45HtoO) = 159,607 + 90,075
= 249,682 g / mol
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2020). Molarmasse. Gjenopprettet fra: en.wikipedia.org
- Nissa Garcia. (2020). Hva er molarmasse? Definisjon, formel og eksempler. Studere. Gjenopprettet fra: study.com
- Dr. Kristy M. Bailey. (s.f.). Stoichiometry Tutorial
Finding Molar Mass. Gjenopprettet fra: occc.edu - Helmenstine, Anne Marie, Ph.D. (2. desember 2019). Molarmasse Eksempel Problem. Gjenopprettet fra: thoughtco.com



Ingen har kommentert denne artikkelen ennå.