
SIM medium fundament, forberedelse og bruk
De halv SIM er en halvfast og differensiell agar, spesielt designet for å identifisere noen bakterier, hovedsakelig av familien Enterobacteriaceae. Den består av triptein, pepton, jernsulfat, ammoniumsulfat, natriumtiosulfat og agar..
Dette mediet tillater utføring av tre viktige tester: produksjon av hydrogensulfid (HtoS), indoleformasjon og motilitet, derav forkortelsen SIM kommer fra. På grunn av sin store nytte kan den ikke mangle i et bakteriologilaboratorium.

I motsetning til andre medier, må den være halvfast for at bevegelseskapasiteten til noen bakterier skal kunne påvises. I denne forstand fungerer denne testen veldig bra for Enterobacteriaceae, men ikke i ikke-gjærende gramnegative stenger, hvor det er foretrukket å bruke andre metoder, for eksempel hengende dråpe..
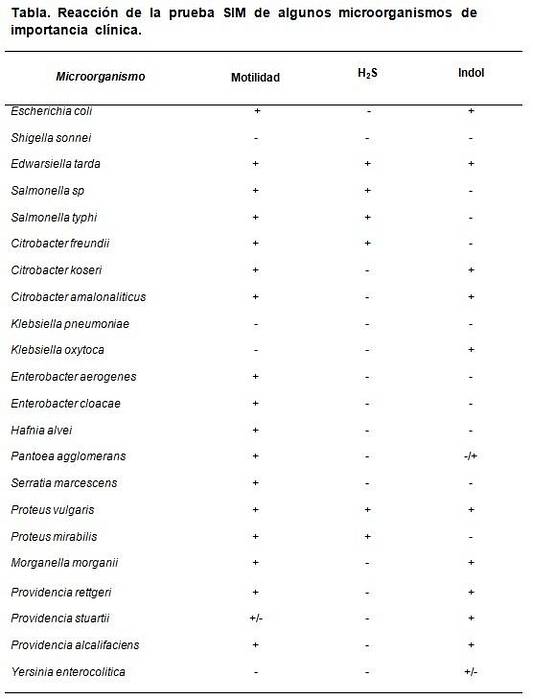
SIM-mediet gjør det mulig å skille visse spesifikke egenskaper som kjennetegner noen bakterier i forhold til andre. For eksempel Escherichia coli er preget av å være HtoS (-), Indole (+) og motilitet (+), mens Proteus mirabilis det er HtoS (+), indol (-), motilitet (+).
Artikkelindeks
- 1 Begrunnelse
- 1.1 Strømkilde
- 1.2 Produksjon av hydrogensulfid
- 1.3 Dannelse av indol
- 1.4 Motilitet
- 2 Klargjøring
- 2.1 Medium SIM
- 2.2 Kovacs reagens
- 2.3 Erlichs reagens
- 3 bruksområder
- 3.1 Såing
- 4 Kvalitetskontroll
- 5 Begrensninger
- 6 Referanser
Basis
Det er et kulturmedium som betraktes som differensial, fordi dets bruk skiller mellom mikroorganismer som er i stand til å produsere hydrogensulfid fra de som ikke gjør det; Det fremhever også de som danner indol fra tryptofan fra de som ikke danner det, og til slutt skiller de bevegelige bakteriene fra de urørlige..
Strømkilde
Som ethvert kulturmedium har den elementer som gir de nødvendige næringsstoffene slik at ikke-krevende mikroorganismer kan utvikle seg. Disse elementene er representert av peptoner og triptein.
Utviklingen av mikroorganismen i mediet er viktig for å kunne observere tilstedeværelsen eller fraværet av egenskapene som dette mediet vurderer..
Produksjon av hydrogensulfid
Bokstaven S i akronymet SIM refererer til produksjon av hydrogensulfid (HtoS). Bakterier som er i stand til å danne hydrogensulfid vil ta opp svovelet fra natriumtiosulfat.
Når HtoS-fargeløs gass, reagerer dette med jernsaltet som er tilstede i mediet og danner jernholdig sulfid, godt synlig (svart bunnfall). Bakterier som ikke danner HtoJa, la midten av originalfargen (beige).
Tilstedeværelsen av det svarte bunnfallet kan hindre tolkningen av motilitet. Imidlertid er det kjent at de fleste H-produserende EnterobacteriaceaetoS er positiv motilitet, slik som Salmonella, Proteus og Citrobacter. I tillegg antyder det svarte bunnfallet som dekker nesten hele mediet, positiv motilitet.
Indolformasjon
Den andre bokstaven i akronymet SIM er "I", som representerer dannelsen av indol.
Slik sett oppfyller triptein, i tillegg til å være en kilde til næringsstoffer, en annen grunnleggende funksjon. Denne peptonen er rik på en aminosyre som kalles tryptofan, derfor kan den vise bakteriene som produserer tryptofanase.
Dette enzymet er ansvarlig for spaltning av aminosyren tryptofan, med den påfølgende dannelsen av indol (fargeløs substans), pyruvinsyre og ammonium.
Det er derfor, for å demonstrere denne reaksjonen, er det nødvendig å tilsette et avslørende stoff (Ehrlichs reagens eller Kovacs reagens). Enten reagerer med indol og danner en rød-fuchsia-ringformet substans på overflaten av agaren. Hvis fuchsia-ringen vises, tolkes indol-testen som positiv.
Bakterier som ikke har dette enzymet, vil ikke danne ringen, og den tolkes som en negativ indoltest.
Det er viktig å merke seg at indoltesten skal være den siste som skal tolkes, siden mediet når det er tilsatt, blir uklart, noe som gjør det vanskelig å visualisere motilitet..
Motilitet
Til slutt betyr bokstaven "M" i ordet SIM motilitet. For å være i stand til å evaluere motilitet, er dette mediet strategisk halvfast, siden denne karakteristikken er viktig for å kunne observere om det er bakteriell bevegelse eller ikke. Bakterier som har flagella er de som gir denne positive testen.
En positiv test vil være tydelig når det blir observert turbiditet, både i det første inokulatet og rundt det. Mens ikke-bevegelige bakterier bare utvikler seg i banen til det første inokulatet.
Forberedelse
Medium SIM
Vei 30 g av det dehydratiserte mediet og oppløs det i en liter destillert vann. Blandingen får stå i 5 minutter og deretter oppvarmet til kokende, omrøres ofte til den er helt oppløst..
Fordel blandingen i reagensglass med bomullshetter og autoklav ved 121 ° C i 15 minutter. Fjern rørstativet fra autoklaven og la det stivne i vertikal stilling, slik at mediet er i form av en blokk.
For å bevare den oppbevares den i kjøleskapet til den brukes. Det tilberedte mediet må ha en slutt-pH på 7,3 ± 0,2.
Når mediet inokuleres, må det ha romtemperatur. Midterfargen er beige.
Kovacs reagens
Mål 150 ml amyl eller isoamyl eller butylalkohol. (Bruk en av de tre nevnte).
Oppløs 10 g p-dimetylaminobensaldehyd. Tilsett deretter langsomt 50 ml konsentrert saltsyre.
Reagenset som er klart til bruk er fargeløst eller lysegult. Den skal oppbevares i en gul flaske og oppbevares i kjøleskap. Ikke bruk hvis den får en mørk brun farge; som indikerer at den er skadet. Dette reagenset er foretrukket når det gjelder Enterobacteriaceae.
Erlichs reagens
Vei opp 2 g p-dimetylaminobensaldehyd og oppløs i 190 ml absolutt etylalkohol og bland sakte med 40 ml konsentrert saltsyre. Oppbevar Kovacs reagens på samme måte. Ehrlichs reagens brukes mer til ikke-gjærende og anaerobe bakterier.
applikasjoner
SIM-medium er sterkt brukt i bakteriologilaboratorier. Det har fordelen at tre essensielle egenskaper ved identifikasjon av Enterobacteriaceae kan observeres i samme rør..
Sådd
Den riktige måten å så dette mediet på er å bruke nålen, som en del av den rene kolonien som skal studeres med blir tatt og satt loddrett inn i midten av mediet. Et enkelt utfall bør utføres. Punkteringen skal ikke nå bunnen av røret, det riktige er å dekke bare to tredjedeler av dybden.
Det anbefales ikke å gjenta inokulatet, da dette kan føre til falske tolkninger av positiv motilitet. Det inokulerte mediet inkuberes aerobt ved 37 ° C i 24 timer..
Etter tiden observeres det om det var produksjon av H eller ikketoS og motilitet leses. Til slutt avsløres indolen, tilsett 3 til 4 dråper av Ehrlich eller Kovac's reagens, bland forsiktig og tolk.
QA
Som en sterilitetskontroll inkuberes ett eller to rør uten inokulering i en ovn ved 37 ° C i 24 timer. Det forventes at det etter denne tiden ikke vil være noen vekst eller fargeendring.
Som kvalitetskontroll kan sertifiserte kjente stammer brukes, for eksempel: Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Klebsiella pneumoniae ATCC 13883, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 29930, Proteus vulgaris ATCC 13315.
De forventede resultatene er: Escherichia coli HtoS negativ, indol og positiv motilitet, Enterobacter aerogenes bare positiv motilitet, Salmonella typhimurium HtoS og positiv motilitet, med negativ indol. Proteus vulgaris alle positive, mens Klebsiella pneumoniae Y Shigella sonnei alle negative.
Begrensninger
-Noen stammer av Morganella morganii, Blant andre stammer kan de produsere et brunaktig pigment i dette mediet på grunn av produksjonen av melanin, dette bør ikke forveksles med bunnfallet av jernholdig sulfid. Hos uerfarne fagpersoner kan denne situasjonen generere falske positive i tolkningen av H-testen.toS.
-Strenge aerobe bakterier vil bare vokse på overflaten av røret, noe som gjør det vanskelig å tolke motilitet.
Referanser
- BD Laboratories. BBL SIM Medium. 2008. Tilgjengelig på: bd.com
- Neogen Laboratories. SIM Medium. Tilgjengelig på: matsikkerhet
- Difco Francisco Soria Melguizo. SIM Medium. 2009. Tilgjengelig på: http://f-soria.es
- Brizuela-Lab Laboratory. Medium SIM. Tilgjengelig på: .brizuela-lab.com
- Britannia Laboratories. Medium SIM. 2015.Tilgjengelig på: studyres.es/doc
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. utg. Redaksjonell Panamericana S.A. Argentina.

Ingen har kommentert denne artikkelen ennå.