
Dalton Atomic Model postulerer og feil

De Daltons atommodell eller Daltons atomteori, Det var et forslag presentert mellom 1803 og 1807 av den engelske kjemikeren og matematikeren John Dalton. Dette var det første forslaget om en konseptuell organisering angående atommers struktur og funksjon..
Daltons modell er også kjent som en sfærisk modell, siden den foreslår det faktum at atomet er en udelelig, solid og kompakt sfære. Denne modellen gjorde det mye lettere å forklare kjemi for resten av verden, og det var grunnlaget for de mange innovative forskningsprosjektene som fulgte. Det var mulig å forklare hvorfor stoffer reagerte i visse tilstander.
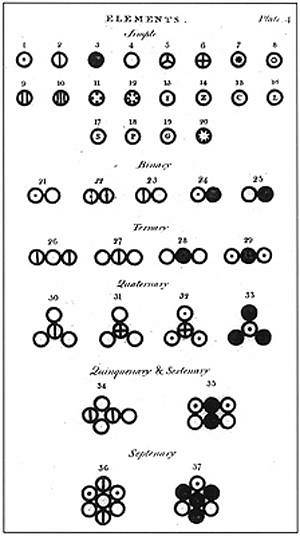
I følge Dalton var materie sammensatt av en minimal enhet kalt et atom, som ikke kunne bli ødelagt eller delt på noen måte. Denne enheten, tidligere foreslått av Democritus og hans mentor Leucippus, var grunnlaget for Daltons forskning og opprettelsen av hans atommodell..
Med denne atomteorien prøvde John Dalton å ta opp de greske filosofenes ideer om atomets eksistens (atomteori i universet), men brukte som en plattform forskjellige laboratorieeksperimenter som tillot ham å demonstrere sine ideer..
Artikkelindeks
- 1 Postulater av Daltons Atomic Model
- 1.1 Postulat 1
- 1.2 Postulat 2
- 1.3 Postulat 3
- 1.4 Postulat 4
- 1.5 Postulat 5
- 1.6 Postulat 6
- 2 feil av Daltons Atomic Model
- 2.1 Formel av vann
- 2.2 Sammensetning av atomer
- 3 Konklusjoner
- 4 Daltons viktigste bidrag
- 4.1 Forløper for atomteorier
- 4.2 La grunnlaget for moderne kjemi
- 4.3 Først publiserte du en tabell over kjemiske vekter
- 4.4 Navngi fargeblindhet
- 5 Artikler av interesse
- 6 Referanser
Dalton Atomic Model Postulates
Dalton formulerte sin atommodell med 6 postulater der han forklarte hva han baserte sine studier på og hvordan han gjennomførte dem.
Postulat 1

I det øvre bildet er et sammendrag av Daltons modell representert: atomene ville være udelelige, uforgjengelige og homogene små kuler.
Daltons første postulat slo fast at elementene består av små partikler som kalles atomer, som ikke kan deles eller ødelegges..
Likeledes kommenterte Dalton at partiklene ikke kunne endre seg i noen kjemisk reaksjon.
Postulat 2

Daltons andre postulat slo fast at alle atomene som er tilstede i samme element er like både i vekt og i andre egenskaper.
På den annen side etablerte den også at atomene til forskjellige elementer har forskjellige masser. Fra dette forslaget oppsto kunnskapen om de relative atomvektene som ble demonstrert når man sammenligner forskjellige grunnstoffer med hydrogen..
Postulat 3

Daltons tredje postulat uttalte at atomer er udelelige selv når de kombineres i kjemiske reaksjoner. De kan heller ikke opprettes eller ødelegges.
Kombinasjonen av atomer, både de samme og forskjellige, vil generere mer komplekse forbindelser, men denne prosessen vil ikke endre det faktum at atomet er den minste materieenheten..
Postulat 4
Daltons fjerde postulat slo fast at selv når atomer kombineres for å danne en forbindelse, vil de alltid ha et forhold som kan uttrykkes i enkle og komplette tall. Dette uttrykket vil ikke vises i brøker, siden atomene er udelbare.
Postulat 5
Daltons femte postulat slo fast at det er en mulig kombinasjon av forskjellige atomer i forskjellige proporsjoner for å danne mer enn en forbindelse..
På denne måten kan det forklares at all eksisterende materie i universet har kommet fra et endelig antall atomer..
Postulat 6
Daltons sjette og siste postulat slo fast at hver kjemiske forbindelse ble opprettet fra kombinasjonen av atomene til to eller flere forskjellige elementer..
Dalton Atomic Model Feil
Som alle teorier i vitenskapens verden var det mange tilbakevistelser angående modellen foreslått av Dalton, som ble demonstrert gjennom årene og etterlot Daltons innovative ideer..
Vannformel
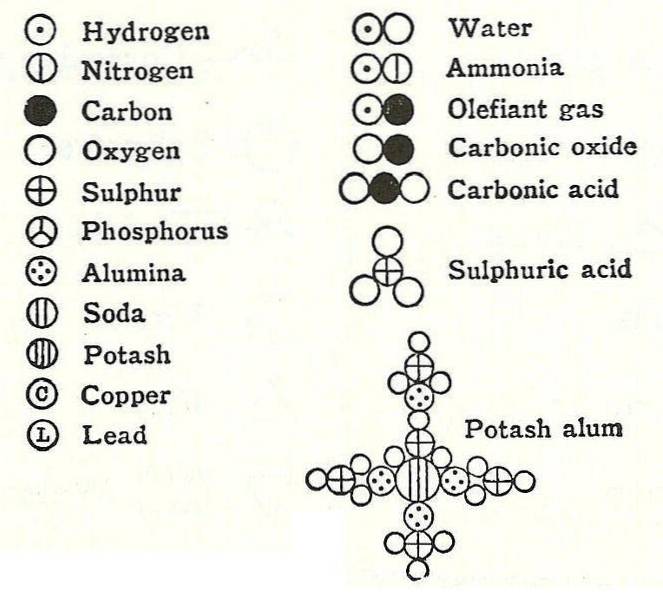
Et eksempel på dette var argumentet fra Dalton om vannformelen, som ifølge ham var sammensatt av et hydrogen og et oksygen.
På grunn av denne påstanden var det mange beregningsfeil angående masse og vekt på noen basiske forbindelser som var basert på denne informasjonen..
Noen få år senere tilbakeviste de europeiske forskerne Gay-Lussac og Alexander von Humbodt denne informasjonen og viste at vann faktisk var sammensatt av to hydrogener og ett oksygen. 6 år senere spesifiserte Amadeo Avogadro den nøyaktige sammensetningen av vannet, og på grunn av det er det Avogadros lov.
Sammensetning av atomer
På den annen side ble den sanne sammensetningen av atomer i det 20. århundre avslørt. I dette tilfellet ble det vist at det er en mindre enhet som protoner, elektroner og nøytroner.
Likeledes kom eksistensen av de forskjellige atomvektene som ble etablert i det periodiske systemet til Mendeleev og Meyer, eksistensen av isotoper og de mer spesifikke kjemiske egenskapene..
Konklusjoner
Til tross for hans feil var John Daltons bidrag av stor relevans i vitenskapens verden og forårsaket oppstandelse i sin tid på grunn av den store mengden informasjon han ga.
Hans vitenskapelige bidrag er fortsatt gyldige og blir fortsatt studert i dag..
Daltons atommodell ble ikke stilt spørsmålstegn ved i flere tiår på grunn av dens relevans i vitenskapens verden og sin nøyaktige forklaring av undersøkelsene og hypotesene som ble presentert på den tiden i vitenskapshistorien..
Daltons viktigste bidrag
Hans bidrag til vitenskapens verden var hovedsakelig å avklare og formulere hypoteser om naturen gjennom kvantitative tester.
Forskeren døde av et hjerteinfarkt 27. juli 1884 i Manchester og mottok kort tid senere utmerkelser av monarkiet.
Forløper for atomteorier
John Dalton var en engelsk kjemiker, matematiker og naturforsker. Han ble født 6. september 1766 i Cumberland, Storbritannia, og er kjent som en av forløperne for atomteorier fra det øyeblikket han presenterte sin atommodell..
La grunnlaget for moderne kjemi
Dalton er kjent som en av forløperne i å lage en tabell over relative vekter for kjemiske elementer. Dette faktum bidro til å legge grunnlaget for det vi i dag kjenner til moderne kjemi..
Først med å publisere en tabell over kjemiske vekter
Dalton var den første forskeren som fikk æren av å publisere en tabell med atomvekter som inkluderte elementer som hydrogen, oksygen, fosfor, karbon og svovel. Takket være denne publikasjonen begynte Dalton å jobbe og å forme det som ville være hans atommodell.
Navngi fargeblindhet
Det skal bemerkes at Dalton var en av de første registrerte personene med visuelle problemer for å fange farger, og på grunn av ham er denne tilstanden kalt fargeblindhet..
Artikler av interesse
Schrödingers atommodell.
Atomic de Broglie-modellen.
Chadwick Atomic Model.
Heisenberg atommodell.
Perrins atommodell.
Thomsons atommodell.
Dirac Jordan atommodell.
Atomic model of Democritus.
Atomisk modell av Leucippus.
Bohr atommodell.
Rutherford atommodell.
Nåværende atommodell.
Referanser
- Daltons atomteori. Hentet 24. november 2017 fra Khanacademy: www.khanacademy.org
- Daltons Atomic Theory. Hentet 24. november 2017 fra Indiana University Northwest: iun.edu
- Atomteori. Hentet 24. november 2017 fra Encyclopædia Britannica: www.britannica.com
- Atomic Theory. Hentet 24. november 2017 fra Wikipedia: en.wikipedia.org
- Atomstrukturens historie. Hentet 24. november 2017 fra Lumen: courses.lumenlearning.com.


Ingen har kommentert denne artikkelen ennå.