
Anisoles struktur, egenskaper, nomenklatur, risiko og bruksområder
De anisol eller metoksybenzen er en organisk forbindelse som består av en aromatisk eter hvis kjemiske formel er C6H5OCH3. Dens fysiske tilstand er den av en fargeløs væske, som kan gi gulaktige fargestoffer. Det gjenkjennes lett av sin karakteristiske anislukt.
Det er da en flyktig forbindelse og ikke veldig høye kohesjonskrefter; typiske kjennetegn ved lette etere, som lagres i små forseglede beholdere. Spesielt er anisol den enkleste av alkylaryleterne; det vil si de med en aromatisk komponent (Ar) og en annen alkylkomponent (R), Ar-O-R.
Gruppe C6H5- kommer til å betegne Ar, og -CH3 til R, og har dermed C6H5-O-CH3. Den aromatiske ringen, og tilstedeværelsen av -OCH3 Som en substituentgruppe kalt metoksy, gir den anisolen en nukleofilisitet som er bedre enn benzen og nitrobenzen. Derfor fungerer det som et mellommolekyl for syntese av forbindelser med farmakologisk aktivitet..
Den karakteristiske anislukten har blitt brukt til å tilsette anisol til kosmetiske og hygieneprodukter som krever en behagelig duft..
Artikkelindeks
- 1 Struktur av anisole
- 1.1 Dipolmoment
- 1.2 Krystaller
- 2 eiendommer
- 2.1 Fysisk utseende
- 2.2 Lukt
- 2.3 Smak
- 2.4 Molekylær masse
- 2,5 Tetthet
- 2.6 Damptetthet
- 2.7 Smeltepunkt
- 2.8 Kokepunkt
- 2.9 Flammepunkt
- 2.10 Selvantennelsestemperatur
- 2.11 Viskositet
- 2.12 Overflatespenning
- 2.13 Brytningsindeks
- 2.14 Løselighet
- 2.15 nukleofilisitet
- 2.16 Reaktivitet
- 3 Nomenklatur
- 4 Risiko
- 5 bruksområder
- 5.1 Organiske synteser
- 5.2 Dufter
- 6 Referanser
Anisole struktur
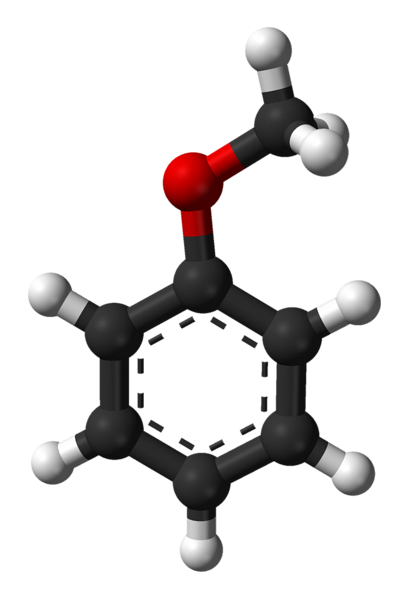
Det øvre bildet viser den molekylære strukturen til anisol ved hjelp av en modell for kuler og stenger. Den aromatiske ringen er verdsatt, hvis karbon er spto og derfor er det flatt, som et sekskantet ark; og knyttet til den er metoksygruppen, hvis karbon er sp3, og dets hydrogener er over eller under ringplanet.
Betydningen av -OCH-gruppen3 i strukturen går den utover å bryte med molekylets plane geometri: den gir polaritet på den, og følgelig får det apolare molekylet av benzen et permanent dipolmoment.
Dipole øyeblikk
Dette dipolmomentet skyldes oksygenatomet, som tiltrekker seg elektrontettheten til både de aromatiske og metylringene. Takket være dette kan anisolmolekyler samhandle gjennom dipol-dipolkrefter; Selv om den mangler muligheten for å danne hydrogenbindinger, da det er en eter (ROR har ikke H knyttet til oksygen).
Det høye kokepunktet (154 ° C) sertifiserer eksperimentelt de sterke intermolekylære interaksjonene som styrer væsken. Likeledes er spredningskreftene i London tilstede, avhengig av molekylmassen, og π-π-interaksjonene mellom selve ringene.
Krystaller
Strukturen til anisolen tillater imidlertid ikke at den interagerer sterkt nok til å adoptere et fast stoff ved romtemperatur (smp = -37 ° C). Dette kan også skyldes at når de intermolekylære avstandene reduseres, begynner de elektrostatiske frastøtingene mellom elektronene i nærliggende aromatiske ringer å få mye kraft..
Derfor, og ifølge krystallografiske studier, kan anisolmolekylene i krystaller ved en temperatur på -173 ° C ikke ordnes på en slik måte at ringene deres vender mot hverandre; det vil si at deres aromatiske sentre ikke er på linje hverandre, men snarere en gruppe -OCH3 er over eller under en nærliggende ring.
Eiendommer
Fysisk utseende
Fargeløs væske, men som kan ha svake stråfargede toner.
Lukt
Lukter litt likt anisfrø.
Smak
Sukkertøy; den er imidlertid moderat giftig, så denne testen er farlig.
Molekylær masse
108,140 g / mol.
Tetthet
0,995 g / ml.
Damptetthet
3,72 (i forhold til luft = 1).
Smeltepunkt
-37 ° C.
Kokepunkt
154ºC.
antennelsespunkt
125ºC (åpen kopp).
Selvantennelsestemperatur
475ºC.
Viskositet
0,778 cP ved 30 ° C.
Overflatespenning
34,15 dynes / cm ved 30ºC.
Brytningsindikator
1.5179 ved 20 ° C.
Løselighet
Dårlig løselig i vann (ca. 1 mg / ml). I andre løsningsmidler, som aceton, etere og alkoholer, er det imidlertid veldig løselig.
Nukleofilisitet
Den aromatiske anisringen er rik på elektroner. Dette er fordi oksygen, til tross for at det er et svært elektronegativt atom, bidrar med elektronene fra sin π-sky for å avlokalisere dem gjennom ringen i mange resonansstrukturer. Følgelig reiser flere elektroner gjennom det aromatiske systemet, og derfor øker dets nukleofilisitet..
Økningen i nukleofilisitet er eksperimentelt demonstrert ved å sammenligne reaktiviteten, mot aromatiske elektrofile substitusjoner, med den av benzen. Dermed er den bemerkelsesverdige effekten av -OCH-gruppen bevist.3 på de kjemiske egenskapene til forbindelsen.
På samme måte skal det bemerkes at de elektrofile substitusjoner forekommer i posisjonene ved siden av (-orto) og motsatt (-par) til metoksygruppen; det vil si at det er orto-para regissør.
Reaktivitet
Nukleofilisiteten til den aromatiske anisringen gir allerede et glimt av reaktiviteten. Substitusjonene kan forekomme enten i ringen (begunstiget av nukleofilisiteten), eller i selve metoksygruppen; i sistnevnte er O-CH-båndet brutt3 for å erstatte -CH3 av en annen alkylgruppe: O-alkylering.
Derfor, i en alkyleringsprosess, kan anisolen akseptere en R-gruppe (fragment av et annet molekyl) ved å erstatte et H på ringen (C-alkylering), eller ved å erstatte CH3 av metoksygruppen. Følgende bilde illustrerer det som nettopp er sagt:
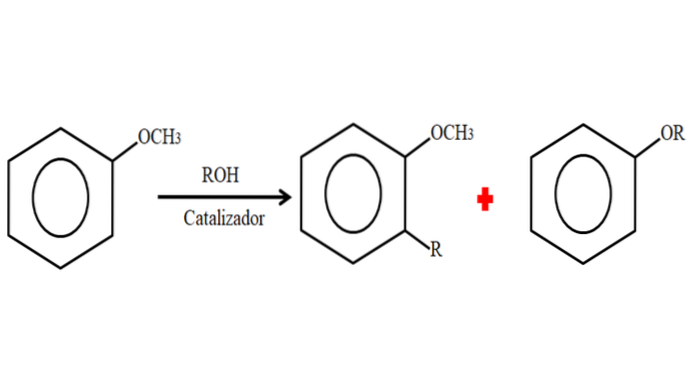
På bildet er R-gruppen plassert i -orto-posisjonen, men den kan også være i -paraposisjonen, motsatt av -OCH3. Når O-alkylering skjer, oppnås en ny eter med en annen -OR-gruppe.
Nomenklatur
Navnet 'anisole' er den mest kjente og mest aksepterte, sannsynligvis avledet av dens anislignende lukt. Imidlertid er navnet 'metoksybenzen' ganske spesifikt, siden det med en gang fastslår hva som er strukturen og identiteten til denne aromatiske eteren; dette er navnet styrt av den systematiske nomenklaturen.
Et annet mindre brukt, men like gyldig navn er 'fenylmetyleter', som er underlagt tradisjonell nomenklatur. Dette er kanskje det mest spesifikke navnet av alle, siden det direkte indikerer hvilke som er de to strukturelle delene av eteren: fenyl-O-metyl, C6H5-O-CH3.
Risiko
Medisinske studier har ennå ikke klart å demonstrere mulige dødelige effekter av anisol i kroppen ved lave doser. Imidlertid forårsaker det, som nesten alle kjemikalier, irritasjon når det utsettes for lenge og i moderat konsentrasjon av hud, hals, lunger og øyne..
På grunn av nukleofilisiteten til ringen metaboliseres en del av den og er derfor biologisk nedbrytbar. Faktisk, som et resultat av denne egenskapen, viste simuleringer at den ikke kan konsentrere seg i vandige økosystemer siden organismene først nedbryter den; og derfor kan elver, innsjøer eller hav samle seg anisole.
I jord, fordampes den raskt og blir ført bort av luftstrømmer, gitt sin flyktighet. Når det er slik, påvirker det heller ikke vegetarmassene eller plantasjene betydelig.
På den annen side reagerer den atmosfærisk med frie radikaler, og representerer derfor ikke risiko for forurensning for luften vi puster inn..
applikasjoner
Organiske synteser
Fra anisol kan andre derivater oppnås ved aromatisk elektrofil substitusjon. Dette gjør det mulig for den å bli brukt som et mellomprodukt for syntesen av medikamenter, plantevernmidler og løsemidler, som det er ønskelig å legge til sine egenskaper. Syntetiske ruter kan bestå av hovedsakelig C-alkylering eller O-alkylering.
Dufter
I tillegg til bruk for organisk syntese, kan den brukes direkte som et tilsetningsstoff for kremer, salver og parfymer, og inneholder anisdufter til slike produkter..
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. A. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10. utgave.). Wiley pluss.
- Nasjonalt senter for bioteknologisk informasjon. (2019). Anisole. PubChem Database, CID = 7519. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisole. Gjenopprettet fra: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Væskefase-alkylering av anisol og fenol katalysert av niobfosfat. Journal of the Brazilian Chemical Society, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. og Goddard R. (2015). Anisole ved 100 K: den første bestemmelsen av krystallstrukturen. Acta Crystallogr C Struct Chem. Aug. 71 (Pt 8): 664-6. doi: 10.1107 / S2053229615012553
- Kjemisk formulering. (2018). Metoksybenzen Gjenopprettet fra: formulacionquimica.com



Ingen har kommentert denne artikkelen ennå.