
Kationdannelse, forskjeller med anion og eksempler

EN kation det er en kjemisk art som har en positiv ladning. Sammen med anionet danner den to typer eksisterende ioner. Ladningen er et produkt av en mangel på elektroner i atomet, noe som får protonene i kjernen til å utøve en større tiltrekningskraft. For hvert elektron som et nøytralt atom mister, øker den positive ladningen med en enhet..
Hvis et atom mister et elektron, og derfor antall protoner er større enn ett, vil dets positive ladning være +1; hvis du mister to elektroner, vil ladningen være +2, og så videre. Når et kation har en +1 ladning, sies det å være monovalent; på den annen side, hvis ladningen er større enn +1, sies det at kationen er polyvalent.
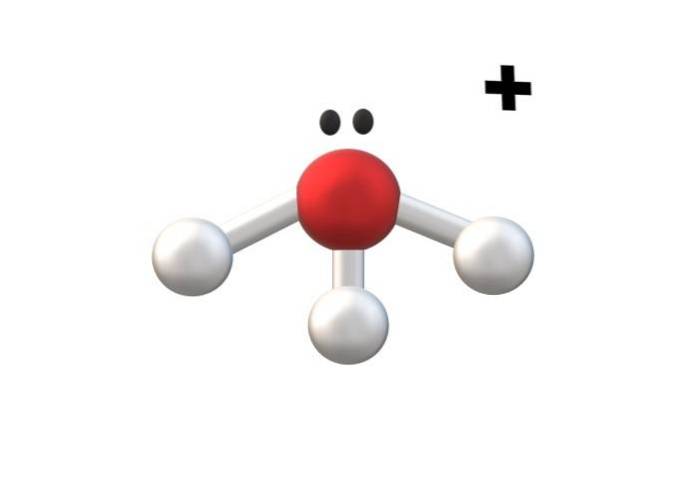
Bildet over viser kationen H3ELLER+, kalt hydroniumion. Som man kan se, har den knapt en ladning på +1, og er følgelig et monovalent kation.
Kationer er viktige arter, da de utøver en elektrostatisk kraft på miljøet og molekylene rundt dem. De presenterer en høy interaksjon med vann, en væske som hydrerer og transporterer dem i fuktige jordarter, for senere å nå plantens røtter og bli brukt til deres fysiologiske funksjoner..
Artikkelindeks
- 1 Hvordan dannes et kation?
- 1.1 Formelle kostnader og flere lenker
- 1.2 Oksidasjon
- 2 Forskjeller med anion
- 3 eksempler på de vanligste kationene
- 3.1 Monatomics
- 3.2 Polyatomics
- 4 Referanser
Hvordan dannes et kation?
Det ble nevnt at når et atom mister et elektron, utøver dets større antall protoner, i forhold til elektroner, en attraktiv kraft som oversettes til en positiv ladning. Men hvordan kan tapet av elektronet oppstå? Svaret avhenger av transformasjonen som skjer i kjemiske reaksjoner.
Det skal bemerkes at tilstedeværelsen av et positivt ladet atom ikke nødvendigvis innebærer dannelsen av et kation. For at det skal betraktes som sådan, må det ikke være et atom med en negativ formell ladning som nøytraliserer det. Ellers ville det være tiltrekning og frastøt i samme forbindelse, og det ville være nøytralt.
Formelle opplastinger og flere lenker
Elektronegative atomer tiltrekker seg elektroner fra deres kovalente bindinger til seg. Selv om elektronene deles likt, vil det komme et punkt der de delvis vil ha færre elektroner enn i basalkonfigurasjonen; dette er dets frie atomer uten å være bundet til andre elementer.
Deretter vil disse elektronegative atomene begynne å oppleve en mangel på elektroner, og med det vil protonene til deres kjerner utøve en større tiltrekningskraft; den positive formelle ladningen er født. Hvis det bare er en positiv formell ladning, vil forbindelsen manifestere en total positiv ionisk ladning; dermed blir kationen født.
Oksygenatomet i kationen H3ELLER+ Det er et trofast eksempel på det ovennevnte. Ved å ha tre O-H-bindinger, en mer enn i vannmolekylet (H-O-H), opplever den tapet av et elektron fra basaltilstanden. Formelle beregninger av ladning lar deg bestemme når dette skjer.
Hvis det antas dannelsen av en annen O-H-binding et øyeblikk, vil det toverdige kation H oppnås4ELLERto+. Merk at den toverdige ladningen på toppen av kationet er skrevet som følger: nummer etterfulgt av '+' symbolet; på samme måte fortsetter vi med anionene.
Oksidasjon
Metaller er kationdannere. Imidlertid kan ikke alle av dem danne kovalente bindinger (eller i det minste rent kovalente bindinger). I stedet mister de elektroner for å etablere ionebindinger: en positiv ladning tiltrekker seg en negativ, holdt sammen av fysiske krefter..
Derfor mister metaller elektroner for å gå fra M til Mn+, hvor n det er vanligvis lik antall grupper i periodisk tabell; selv om n det kan ta flere heltallverdier, noe som er spesielt tilfelle med overgangsmetaller. Dette tapet av elektroner finner sted i en type kjemisk reaksjon som kalles oksidasjon..
Metaller oksiderer, mister et elektron, antall protoner i deres atomer overstiger antallet av elektroner, og har derfor en positiv ladning. For at oksidasjon skal skje, må det være et oksidasjonsmiddel som reduserer eller får elektronene tapt av metaller. Oksygen er det mest kjente oksidasjonsmiddel av alle.
Forskjeller med anion
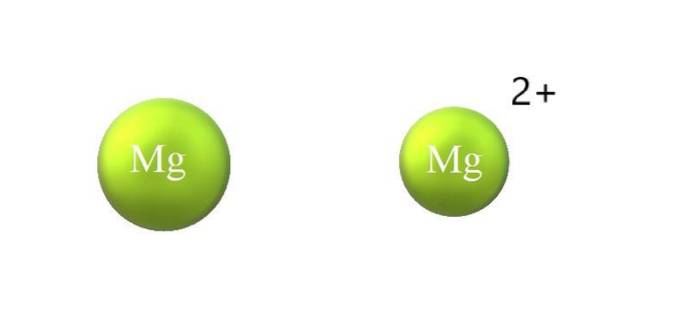
Oppført nedenfor er forskjellene mellom et kation og anion:
-Kationet generelt er mindre enn anionet. Bildet over viser hvordan Mgs atomeradius reduseres ved å miste to elektroner og bli Mg-kationen.to+; det motsatte skjer med anioner: de blir mer omfangsrike.
-Den har flere protoner enn elektroner, mens anionen har flere elektroner enn protoner..
-Å være mindre, dens ladetetthet er høyere, og derfor har den en større polariserende kraft; det vil si at den deformerer elektronskyene til nærliggende atomer.
-Et kation beveger seg i samme retning som det påførte elektriske feltet, mens anionet beveger seg i motsatt retning.
Eksempler på de vanligste kationene
Monatomisk
De monatomiske kationene kommer hovedsakelig fra metaller (med visse unntak, for eksempel H+). Av resten er det ekstremt sjelden å vurdere et kation avledet fra et ikke-metallisk element.
Det vil sees at mange av dem er forskjellige eller flerverdige, og at størrelsen på ladningene deres stemmer overens med antall grupper i periodisk tabell..
-Li+
-Na+
-K+
-Rb+
-Cs+
-Fr+
-Ag+
Alle har til felles ladningen '1+', som er skrevet uten å måtte angi tallet, og kommer også fra gruppe 1: alkalimetallene. Dessuten er det kationen Ag+, en av de vanligste av overgangsmetallene.
-Væreto+
-Mgto+
-ACto+
-MRto+
-Bato+
-Rato+
Disse toverdige kationene er avledet fra deres respektive metaller som tilhører gruppe 2: jordalkalimetallene..
-Til3+
-Ga3+
-I3+
-Tl3+
-Nh3+
Trivalente kationer av borgruppen.
Så langt har eksemplene blitt karakterisert som å ha en enkelt valens eller ladning. Andre kationer viser mer enn en valens eller positiv oksidasjonstilstand:
-Snto+
-Sn4+ (tinn)
-Coto+
-Co3+ (kobolt)
-Au+
-Au3+ (gull)
-Troto+
-Tro3+ (jern)
Og andre metaller, som mangan, kan ha enda flere valenser:
-Mnto+
-Mn3+
-Mn4+
-Mn7+
Jo høyere ladning, desto mindre og mer polariserende kation..
Polyatomisk
Uten å gå inn i organisk kjemi, er det uorganiske og polyatomiske kationer som er veldig vanlige i det daglige; som for eksempel:
-H3ELLER+ (hydronium, allerede nevnt).
-NH4+ (ammonium).
-IKKEto+ (nitronium, til stede i nitreringsprosesser).
-PH4+ (fosfonium).
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Helmenstine, Anne Marie, Ph.D. (5. mai 2019). Kation Definisjon og eksempler. Gjenopprettet fra: thoughtco.com
- Wyman Elizabeth. (2019). Kation: Definisjon og eksempler. Studere. Gjenopprettet fra: study.com
- Dumminger. (2019). Positive og negative ioner: kationer og anioner. Gjenopprettet fra: dummies.com
- Wikipedia. (2019). Kation. Gjenopprettet fra: es.wikipedia.org


Ingen har kommentert denne artikkelen ennå.