
Amfipatiske molekylers struktur, egenskaper, eksempler
De amfipatiske eller amfifile molekyler De er de som kan føle affinitet eller frastøt samtidig for et bestemt løsemiddel. Løsemidler er kjemisk klassifisert som polare eller apolare; hydrofile eller hydrofobe. Dermed kan disse typer molekyler "elske" vann, akkurat som de også kan "hate" det..
I følge den forrige definisjonen er det bare en måte for at dette skal være mulig: disse molekylene må ha polære og apolare regioner innenfor sine strukturer; Enten er de mer eller mindre homogent fordelt (slik det er for eksempel med proteiner), eller så er de heterogent lokalisert (når det gjelder overflateaktive stoffer)

Surfaktanter, også kalt vaskemidler, er kanskje de mest kjente amfipatiske molekylene fra alle tider. Helt siden mennesket ble betatt av den rare fysiognomien til en boble, bekymret for tilberedning av såper og rengjøringsprodukter, har han kommet over fenomenet overflatespenning gang på gang.
Å observere en boble er det samme som å være vitne til en "felle" hvis vegger, dannet av innretting av amfipatiske molekyler, beholder luftens gassinnhold. Dens sfæriske former er de mest matematiske og geometriske stabile, siden de reduserer overflatespenningen til luft-vann-grensesnittet til et minimum..
Når det er sagt, har to andre kjennetegn ved amfipatiske molekyler blitt diskutert: de har en tendens til å assosiere eller montere seg selv, og noen lavere overflatespenninger i væsker (de som kan gjøre det kalles overflateaktive stoffer).
Som et resultat av den høye tendensen til å assosiere, åpner disse molekylene et felt for morfologisk (og til og med arkitektonisk) studie av deres nanoaggregater og supramolekylene som komponerer dem; med det formål å designe forbindelser som kan funksjonaliseres og samhandle på umåtelige måter med celler og deres biokjemiske matriser.
Artikkelindeks
- 1 Struktur
- 1.1 Intermolekylære interaksjoner
- 1.2 Diverse
- 2 Kjennetegn ved amfipatiske molekyler
- 2.1 Forening
- 2.2 Fysisk
- 3 eksempler
- 4 Søknader
- 4.1 Cellemembraner
- 4.2 Dispergeringsmidler
- 4.3 Emulgatorer
- 4.4 Vaskemidler
- 4.5 Antioksidanter
- 5 Referanser
Struktur
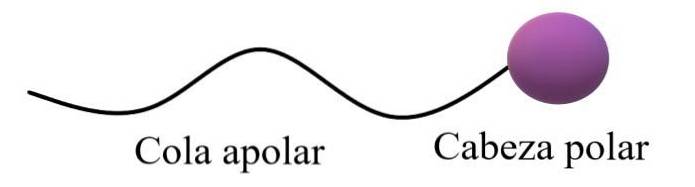
Amfifile eller amfipatiske molekyler ble sagt å ha en polar region og en apolar region. Den apolare regionen består vanligvis av en mettet eller umettet karbonkjede (med dobbelt- eller trippelbindinger), som er representert som en "apolar hale"; ledsaget av et “polarhode” der de mest elektronegative atomer befinner seg.
Den øvre generelle strukturen illustrerer kommentarene i forrige avsnitt. Polarhodet (lilla sfære) kan være funksjonelle grupper eller aromatiske ringer som har permanente dipolmomenter, og som også er i stand til å danne hydrogenbindinger. Derfor bør det høyeste oksygen- og nitrogeninnholdet være plassert der.
I dette polare hodet kan det også være ioniske, negative eller positive ladninger (eller begge samtidig). Denne regionen er den som viser høy affinitet for vann og andre polare løsemidler..
På den annen side samhandler den apolare halen, gitt sine dominerende C-H-bindinger, gjennom spredningsstyrker i London. Denne regionen er ansvarlig for at amfipatiske molekyler også viser affinitet for fett og apolare molekyler i luften (Nto, COto, Ar osv.).
I noen kjemitekster sammenlignes modellen for den øvre strukturen med formen på en slikkepinne.
Intermolekylære interaksjoner
Når et amfipatisk molekyl kommer i kontakt med et polært løsningsmiddel, for eksempel vann, har dets regioner forskjellige effekter på løsemiddelmolekylene..
Til å begynne med søker vannmolekylene å solvatere eller hydrere polarhodet, og holder seg borte fra den apolare halen. I denne prosessen skapes molekylær lidelse.
I mellomtiden har vannmolekylene rundt den apolare halen en tendens til å ordne seg som om de var små krystaller, og dermed la dem minimere frastøt. I denne prosessen opprettes en molekylær orden.
Mellom lidelser og ordrer vil det komme et punkt der det amfipatiske molekylet vil søke å samhandle med en annen, noe som vil resultere i en mye mer stabil prosess.
Diverse
Begge vil bli kontaktet gjennom apolare haler eller polarhoder, på en slik måte at relaterte regioner samhandler først. Dette er det samme som å forestille seg at to "lilla lollipops" på bildet over, nærmer seg ved å flette de svarte halene, eller bli med de to lilla hodene..
Og dermed begynner et interessant assosiasjonsfenomen, der flere av disse molekylene blir sammenhengende. De er ikke tilknyttet vilkårlig, men i henhold til en rekke strukturelle parametere, som ender opp med å isolere de apolare halene i en slags "apolar kjerne", mens de eksponerer polarhodene som et polar skall..
Det sies da at en sfærisk miscella er født. Imidlertid er det under innledningen av miscelaen et foreløpig stadium som består av det som er kjent som et lipid dobbeltlag. Disse og andre er noen av de mange makrostrukturene som amfifile molekyler kan bruke.
Kjennetegn ved amfipatiske molekyler
assosiasjon

Hvis de apolare halene blir tatt som svarte enheter, og polarhodene som lilla enheter, vil det forstås hvorfor i det øvre bildet er barken til miscelen lilla og kjernen er svart. Kjernen er apolar, og dens interaksjoner med vann- eller løsningsmiddelmolekylene er null..
Hvis løsningsmidlet eller mediet derimot er apolært, er det polarhodene som vil lide frastøting, og følgelig vil de være plassert i sentrum av miscellaen; det vil si at den er invertert (A, nedre bilde).
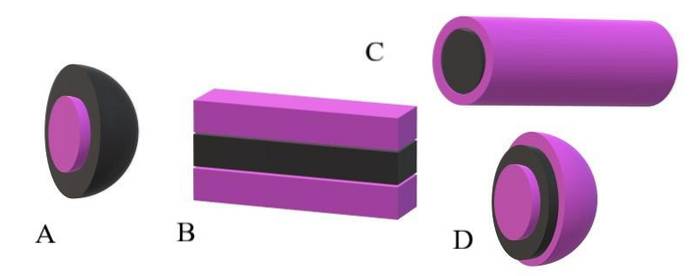
Det observeres at den omvendte miscellen har et svart apolært skall og en lilla polarkjerne. Men før flekker dannes, blir de amfifile molekylene funnet hver for seg og endrer rekkefølgen på løsemiddelmolekylene. Økt konsentrasjon, de begynner å assosiere seg i en struktur med ett eller to lag (B).
Fra B begynner laminatene å kurve for å danne D, en vesikkel. En annen mulighet, avhengig av formen på den apolare halen med hensyn til dens polære hode, er at de assosierer for å gi opphav til en sylindrisk miscella (C).
Nanoaggregater og supramolekyler
Det er derfor fem hovedstrukturer, som avslører et grunnleggende kjennetegn ved disse molekylene: deres høye tendens til å assosiere og selvmontere til supramolekyler, som samler seg for å danne nanoaggregater..
Dermed blir amfifile molekyler ikke funnet alene, men i tilknytning..
Fysisk
Amfipatiske molekyler kan være nøytrale eller ionisk ladede. De som har negative ladninger har et oksygenatom med en negativ formell ladning i polarhodet. Noen av disse oksygenatomene kommer fra funksjonelle grupper som: -COO-, -SW4-, -SW3- eller -PO4-.
Når det gjelder positive ladninger, kommer de vanligvis fra aminer, RNH3+.
Tilstedeværelsen eller fraværet av disse ladningene endrer ikke det faktum at disse molekylene generelt danner krystallinske faste stoffer; eller, hvis de er relativt lette, blir de funnet som oljer.
Eksempler
Noen eksempler på amfipatiske eller amfifile molekyler vil bli nevnt nedenfor:
-Fofolipider: fosfatidyletanolamin, sfingomyelin, fosfatidylserin, fosfatidylkolin.
-Kolesterol.
-Glykolipider.
-Sodium lauryl sulfate.
-Proteiner (de er amfifile, men ikke overflateaktive stoffer).
-Fenoliske fettstoffer: kardanol, kardoler og anakardiale syrer.
-Cetyltrimetylammoniumbromid.
-Fettsyrer: palmitinsyre, linolsyre, oljesyre, laurinsyre, stearinsyre.
-Langkjedede alkoholer: 1-dodekanol og andre.
-Amfifile polymerer: slik som etoksylerte fenolharpikser.
applikasjoner
Cellemembraner
En av de viktigste konsekvensene av evnen til disse molekylene til å assosiere er at de bygger en slags vegg: lipiddobbelaget (B).
Dette dobbeltlaget utvider seg for å beskytte og regulere inn- og utgang av forbindelser i celler. Det er dynamisk, siden dets apolare haler roterer og hjelper amfipatiske molekyler til å bevege seg..
På samme måte, når denne membranen er festet til to ender, for å ha den vertikalt, brukes den til å måle dens permeabilitet; og med dette oppnås verdifulle data for design av biologiske materialer og syntetiske membraner fra syntesen av nye amfipatiske molekyler med forskjellige strukturelle parametere..
Dispergeringsmidler
I oljeindustrien brukes disse molekylene, og polymerene syntetisert fra dem, til å dispergere asfaltener. Fokus for denne applikasjonen hviler på hypotesen om at asfaltener består av et kolloidalt fast stoff, med høy tendens til å flokkulere og sedimentere som et brunt-svart fast stoff som forårsaker alvorlige økonomiske problemer..
Amfipatiske molekyler bidrar til å holde asfaltener spredt over lengre tid i møte med fysisk-kjemiske endringer i råoljen..
Emulgatorer
Disse molekylene hjelper til med å blande to væsker som ikke vil være blandbare under vanlige forhold. I iskrem hjelper de for eksempel vann og luft til å danne en del av det samme faste stoffet sammen med fett. Blant de mest brukte emulgatorene for dette formålet er de avledet fra spiselige fettsyrer.
Vaskemidler
Den amfifile karakteren til disse molekylene brukes til å fange fett eller apolære urenheter, for senere å bli ført bort samtidig av et polært løsningsmiddel, for eksempel vann..
I likhet med eksemplet på bobler der luft var fanget, fanger oppvaskmidler fett i micellene, som, med et polært skall, samhandler effektivt med vann for å fjerne smuss..
Antioksidanter
Polarhodene er av avgjørende betydning da de definerer de mange bruksområdene disse molekylene kan ha i kroppen.
Hvis de for eksempel har et sett med aromatiske ringer (inkludert derivater av en fenolring) og polære ringer som er i stand til å nøytralisere frie radikaler, vil det være amfifile antioksidanter; og hvis de også mangler toksiske effekter, vil det være nye antioksidanter tilgjengelig på markedet.
Referanser
- Alberts B, Johnson A, Lewis J, et al. (2002). Molecular Biology of the Cell. 4. utgave. New York: Garland Science; Lipid bilayer. Gjenopprettet fra: ncbi.nlm.nih.gov
- Jianhua Zhang. (2014). Amfifile molekyler. Springer-Verlag Berlin Heidelberg, E. Droli, L. Giorno (red.), Encyclopedia of Membranes, DOI 10.1007 / 978-3-642-40872-4_1789-1.
- Sa Joseph. (2019). Definisjon av amfipatiske molekyler. Studere. Gjenopprettet fra: study.com
- Lehninger, A. L. (1975). Biokjemi. (2. utgave). Worth Publishers, Inc..
- Mathews, C. K., van Holde, K. E. og Ahern, K. G. (2002). Biokjemi. (3. utgave). Pearson Addison Weshley.
- Helmenstine, Anne Marie, Ph.D. (31. mars 2019). Hva er et overflateaktivt middel? Gjenopprettet fra: thoughtco.com
- Domenico Lombardo, Mikhail A. Kiselev, Salvatore Magazù og Pietro Calandra (2015). Amfifiler selvmontering: grunnleggende konsepter og fremtidige perspektiver på supramolekylære tilnærminger. Fremskritt innen fysikk med kondensert materie, vol. 2015, artikkel-ID 151683, 22 sider, 2015. doi.org/10.1155/2015/151683.
- Anankanbil S., Pérez B., Fernandes I., Magdalena K. Widzisz, Wang Z., Mateus N. & Guo Z. (2018). En ny gruppe syntetiske fenolholdige amfifile molekyler for flerbruksapplikasjoner: Fysisk-kjemisk karakterisering og celletoksisitetsstudie. Scientific Reportsvolume 8, Artikkelnummer: 832.



Ingen har kommentert denne artikkelen ennå.