
Natriumnitrat (NaNO3) struktur, egenskaper, bruksområder, risiko

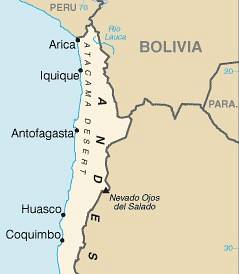
De natriumnitrat er et krystallinsk uorganisk fast stoff dannet av et natriumion Na+ og et nitration NO3-. Den kjemiske formelen er NaNO3. I naturen finnes det som mineralet nitratin eller nitratitt, som finnes i overflod i Atacama-ørkenen i Chile, og det er derfor dette mineralet også kalles chilensk saltpeter eller caliche.
Natriumnitrat er et ikke-brennbart fast stoff, men det kan akselerere oksidasjon eller forbrenning av brennbare materialer. Av denne grunn er det mye brukt i fyrverkeri, eksplosiver, fyrstikker, kullstein og noen typer plantevernmidler, for å drepe gnagere og andre små pattedyr..

Evnen til å fremme forbrenning eller antenning av andre materialer betyr at det må håndteres med stor forsiktighet. Hvis den utsettes for flammer eller ild, kan den eksplodere. Til tross for dette NaNO3 Den brukes i næringsmiddelindustrien da den har konserverende egenskaper, spesielt for kjøtt og noen typer oster..
Imidlertid kan svelging i overkant føre til helseproblemer, spesielt hos gravide kvinner, babyer og barn. Ved å transformere til nitritter i fordøyelsessystemet, kan det forårsake visse sykdommer.
Artikkelindeks
- 1 Kjemisk struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3,5 Tetthet
- 3.6 Løselighet
- 3,7 pH
- 3.8 Andre egenskaper
- 4 Motta
- 4.1 Tilstedeværelse i menneskekroppen
- 5 bruksområder
- 5.1 I næringsmiddelindustrien
- 5.2 I gjødsel
- 5.3 Som promotor eller tilrettelegger for forbrenning eller eksplosjon
- 5.4 Å eliminere gnagere og andre pattedyr
- 5.5 Ved fremstilling av andre forbindelser
- 5.6 Ved utvinning av metaller fra elektronisk avfall
- 5.7 I helse- og treningsforskning
- 5.8 I forskjellige bruksområder
- 6 Risiko
- 6.1 Fare ved håndtering
- 6.2 Problemer knyttet til inntak av mat eller vann
- 7 Natriumnitrat i mat
- 8 Referanser
Kjemisk struktur
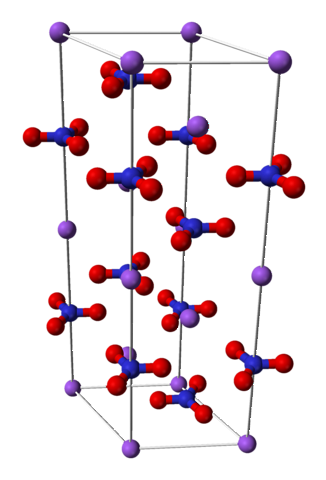
Natriumnitrat består av en natriumkation Na+ og et nitratanion NO3-.
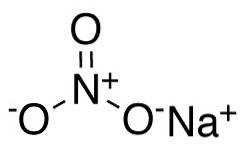
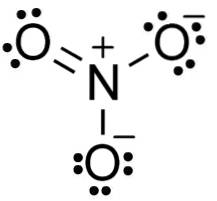
I nitratanionen NO3- nitrogen N har en valens på +5 og oksygen en valens på -2. Av denne grunn har nitratanionen en negativ ladning..
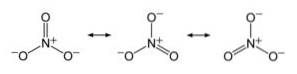
Anion NO3- den har en flat og symmetrisk struktur der de tre oksygene fordeler den negative ladningen likt eller jevnt.
Nomenklatur
-Natriumnitrat
-Natriumnitrat
-Sodium saltpeter (fra engelsk natriumsaltpeter)
-Nitro soda (fra engelsk brusnitre)
-Saltpeter i Chile
-Nitrat fra Chile
-Nitratin
-Nitratitt
-Caliche
Eiendommer

Fysisk tilstand
Fargeløse til hvite faste, trigonale eller rombohedriske krystaller.
Molekylær vekt
84,995 g / mol
Smeltepunkt
308 ºC
Kokepunkt
380 ºC (dekomponerer).
Tetthet
2.257 g / cm3 ved 20 ºC.
Løselighet
Løselig i vann: 91,2 g / 100 g vann ved 25 ºC eller 1 g i 1,1 ml vann. Litt løselig i etanol og metanol.
pH
Natriumnitratløsninger er nøytrale, det vil si verken sure eller basiske, og pH er derfor 7.
Andre egenskaper
Det er et hygroskopisk fast stoff, det vil si at det absorberer vann fra miljøet.

Oppløsningen i vann gjør løsningen kjølig, så det sies at denne oppløsningsprosessen er endoterm, med andre ord når den oppløses absorberer den varme fra omgivelsene, og det er derfor løsningen avkjøles.
Ved veldig lave temperaturer er natriumnitrat løselig i NH flytende ammoniakk3, danner NaNO34NH3 under -42 ºC.
Nano3 Det er ikke brennbart, men dets tilstedeværelse akselererer forbrenningen av materialer eller forbindelser som er. Dette skyldes at når det varmes opp, produserer det oksygen Oto, blant andre gasser.
Å skaffe
Det oppnås hovedsakelig ved ekstraksjon fra mineralforekomster eller salpetergruver i Chile (caliche eller nitratitt). For dette brukes saltlake, og deretter utføres krystallisering og omkrystallisering for å oppnå NaNO-krystaller.3 mer ren.
Disse gruvene finnes hovedsakelig i Sør-Amerika nord i Chile i Atacama-ørkenen. Der er det assosiert med kaliumnitrat KNO3 og nedbrytende organisk materiale.
Det kan også oppnås ved å omsette salpetersyre med natriumkarbonat NatoCO3 eller med natriumhydroksyd NaOH:
2 HNO3 + NatoCO3 → 2 NaNO3 + COto↑ + HtoELLER
Tilstedeværelse i den menneskelige organismen
Natriumnitrat kan komme inn i menneskekroppen gjennom mat og drikkevann som inneholder det..
60-80% av inntatt nitrat kommer fra frukt og grønnsaker. En annen kilde er spekemat. Det brukes av kjøttindustrien for å forhindre vekst av mikrober og for å beholde farge.
Imidlertid kommer en høy andel nitrat som er tilstede i menneskekroppen fra den endogene syntesen eller på grunn av prosesser i kroppen..
applikasjoner
I næringsmiddelindustrien
Det brukes som konserveringsmiddel i matvarer, som et herdemiddel for syltet kjøtt, og som et fargelagringsmiddel for kjøtt. Mat som kan inneholde det er bacon, pølser, skinke og noen oster.

I gjødsel
Natriumnitrat brukes i gjødselblandinger for å gjødsle tobakk, bomull og grønnsaksavlinger.

Som en promotor eller promoter av forbrenning eller eksplosjon
Nano3 den brukes som en oksidant i mange applikasjoner. Det er et fast stoff på oksygen som letter tenningsprosessen ved å produsere Oto.
Tilstedeværelsen av NaNO3 gjør at materialer ikke trenger oksygen fra eksterne kilder for å antennes da det forsyner nok Oto med hensyn til selvopprettholdende eksotermiske (varmegenererende) reaksjoner som oppstår under tenning eller eksplosjon.
Det har lenge vært brukt som den viktigste oksidanten i pyrotekniske materialer (fyrverkeri), som en oksiderende komponent i eksplosiver og detonasjons- eller sprengningsmidler, og som drivmiddel.

Det brukes også til å forbedre forbrenningen av kullsteiner (briketter), for å favorisere belysningen i fyrstikker og til og med for å forbedre tobakkens brennbare egenskaper..
Å eliminere gnagere og andre pattedyr
Det brukes til en spesiell type plantevernmidler. Sammensetningene som inneholder den er pyrotekniske røykemidler som blir plassert og satt i brann i hulene, og frigjør dødelige doser giftige gasser.
Av den grunn brukes den til bekjempelse av forskjellige gnagere, murmeldyr, prærieulver og stinkdyr, i åpne felt, gressletter, ukultiverte områder, plener og golfbaner..
Ved fremstilling av andre forbindelser
Brukes til fremstilling av salpetersyre HNO3, natriumnitritt NaNOto, og fungerer også som en katalysator ved fremstilling av svovelsyre HtoSW4.
Den brukes til fremstilling av lystgass NtoEller og som et oksidasjonsmiddel ved fremstilling av farmasøytiske forbindelser.
Ved utvinning av metaller fra e-avfall
Enkelte forskere fant at NaNO3 muliggjør ikke-forurensende utvinning av metaller som finnes i avfall fra elektronisk utstyr (mobiltelefoner, nettbrett, datamaskiner osv.).
Nyttige metaller som kan ekstraheres fra komponentene i dette elektroniske utstyret er Nickel Ni, Cobalt Co, Manganese Mn, Zink Zn, Copper Cu og Aluminium Al.
Ekstraksjonen utføres med bare en NaNO-løsning3 og en polymer. Og et utbytte på 60% oppnås.
På denne måten kan elektronisk avfall resirkuleres, noe som bidrar til minimering av avfall og stabil gjenvinning av ressurser..
I helse- og treningsforskning
I følge noen studier inntak av NaNO kosttilskudd3 eller matvarer som inneholder det, har naturlig positive helseeffekter. Noen av maten rik på nitrater er rødbeter, spinat og ruccola.
Effekter inkluderer å forbedre det kardiovaskulære systemet, senke blodtrykket, forbedre blodstrømmen og øke mengden oksygen i vev som trener fysisk..
Dette indikerer at bruk av NaNO kan vurderes.3 som en billig medisin i forebygging og behandling av pasienter med blodtrykksproblemer.
I tillegg kan det tjene som et effektivt og naturlig hjelpemiddel for å øke muskelkraften hos idrettsutøvere.
I forskjellige bruksområder

Det brukes som et oksidant og flussmiddel ved fremstilling av glass og keramiske glasurer. Den brukes også i spesielle sementer.
Fungerer som et kjemisk middel i utvinning av tinn fra metallskrot, i latexkoagulering, i kjernefysisk industri og i kontrollen av korrosjon i vandige systemer.
Risiko
Farer ved håndtering
Den har egenskapen til å akselerere forbrenningen av brennbare materialer. Hvis du er involvert i en brann, kan det oppstå en eksplosjon.
Når den utsettes for varme eller ild i lengre perioder, kan den eksplodere og produsere giftige nitrogenoksider..
Problemer knyttet til inntak av mat eller vann
Nitrat ved inntak kan bli nitritt både i munnen og i mage og tarm..
Når nitritt reagerer med aminene i noen matvarer, kan det bli nitrosaminer i et surt miljø som i magen. Nitrosaminer er kreftfremkallende.
Dette skjer imidlertid ikke når frukt og grønnsaker som inneholder nitrater spises naturlig..
I følge noen studier kan tilstedeværelsen av høye nivåer av nitrat produsere en blodsykdom som gjør at oksygen ikke kan frigjøres effektivt i vevet.
Dette kan forekomme hos babyer hvis melkformel er laget av brønnvann som inneholder nitrater..
Det er også observert at høye nivåer av nitrat kan forårsake problemer i svangerskapet hos babyer, forårsaker spontane aborter, for tidlig fødsel eller defekter i fosterets nevrale rør.
Nylig har det blitt funnet at natriumnitrat kan utgjøre en risiko for utviklingen av muskuloskeletalsystemet, og kommunikasjon mellom nerv og muskler påvirkes hos mennesker..
Natriumnitrat i mat

Natriumnitrat er synonymt med kjøtt, fordi de tilsettes dem sammen med nitritt for å bevare dem og forbedre utseendet og smaken. For sin årsak har overdreven inntak av kjøtt (pølser, bacon, skinke, røkt fisk, etc.) vært involvert i den forstyrrende forbindelsen av kreft i hele fordøyelsessystemet..
Selv om forholdet mellom kjøtt behandlet med nitrat-nitritsalter og kreft ikke er absolutt, anbefales det å moderere inntaket.
På den annen side er grønnsaker (gulrøtter, rødbeter, reddiker, salat, spinat osv.) Rik på NaNO3 siden de har absorbert det fra avlingsjord på grunn av dets gjødslingsvirkning. Inntaket av disse grønnsakene, i motsetning til kjøttprodukter, er ikke knyttet til de nevnte sykdommene.
Dette skyldes to grunner: forskjellen i proteinnivået til slike matvarer, og måten de tilberedes på. Når kjøtt blir stekt eller oppvarmet til flammen, fremmes reaksjonen mellom nitrater-nitritter med visse grupper av aminosyrer, slik at det produseres nitrosoaminer: de sanne kreftfremkallende stoffene.
Innholdet av vitamin C, fiber og polyfenoler i grønnsaker reduserer dannelsen av disse nitrosoaminer. Det er derfor NaNO3 alene er ikke en trussel mot maten.
Referanser
- OSS. National Library of Medicine. (2019). Natriumnitrat. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte utgave. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. og Ravanbod, M. (2015). Kinetisk studie av Mg / NaNO3 pyroteknisk ved bruk av ikke-isoterm TG / DSC-teknikk. J Therm Anal Calorim (2015) 119: 2281-2288. Gjenopprettet fra link.springer.com.
- Jarosz, J. et al. (2016). Natriumnitrat reduserer klynging av agrin-indusert acetylkolinreseptor. BMC Farmakologi og toksikologi (2016) 17:20. Gjenopprettet fra bmcpharmacoltoxicol.biomedcentral.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Prival, M.J. (2003). Kreft. Kreftfremkallende stoffer i næringskjeden. I Encyclopedia of Food Sciences and Nutrition (Andre utgave). Gjenopprettet fra sciencedirect.com.
- Zakhodyaeva, Y.A. et al. (2019). Kompleks utvinning av metaller i et vandig tofasesystem basert på poly (etylenoksid) 1500 og natriumnitrat. Molecules 2019, 24, 4078. Gjenopprettet fra mdpi.com.
- Clements, W.T. et al. (2014). Svelging av nitrat: En gjennomgang av helse- og fysiske ytelseseffekter. Næringsstoffer 2014, 6, 5224-5264. Gjenopprettet fra mdpi.com.


Ingen har kommentert denne artikkelen ennå.