
Kaliumnitrit (KNO2) struktur, egenskaper og bruksområder

De kaliumnitritt er et uorganisk salt hvis kjemiske formel er KNOto, som er kjemisk og farmakologisk relatert til kaliumnitrat, KNO3. Dens fysiske utseende består av gulhvite krystaller, svært hygroskopiske og derfor delikatiserende; det vil si at de oppløses raskt i fuktige omgivelser.
Formelen indikerer at andelen K-ioner+ og neito- er 1: 1, og de holdes sammen av elektrostatiske krefter eller ionebindinger. Det ser ut til at det ikke er funnet noen rene naturlige kilder for krystallene, selv om nitrittanioner finnes i jord, gjødsel, planter og dyr..

Bildet over viser hvordan KNO-krystallene ser utto, med uttalt gule toner. Hvis disse krystallene blir igjen i kontakt med luften, vil de absorbere fuktighet til de blir en vandig løsning; løsning som har skapt kontroverser om bruken av den til medisinske formål er gunstig.
På den annen side brukes krystallene i svært små mengder (200 ppm) til å saltgjøre kjøtt og garantere deres konservering mot bakteriell virkning. Likeledes KNOto forbedrer fargen på kjøtt, noe som gjør dem mer rødlige; det er imidlertid underlagt flere begrensninger for å unngå de toksiske effektene av dette saltet i kroppen.
Artikkelindeks
- 1 Struktur av kaliumnitrit
- 2 eiendommer
- 2.1 Molekylær masse
- 2.2 Tetthet
- 2.3 Smeltepunkt
- 2.4 Kokepunkt
- 2.5 Løselighet i vann
- 2.6 Deliquescence
- 2.7 Løselighet i andre løsningsmidler
- 2,8 pH
- 3 Nomenklatur
- 4 Motta
- 5 bruksområder
- 5.1 Tilsetningsstoff og reagens
- 5.2 Motgift
- 5.3 Leger
- 6 Referanser
Struktur av kaliumnitrit
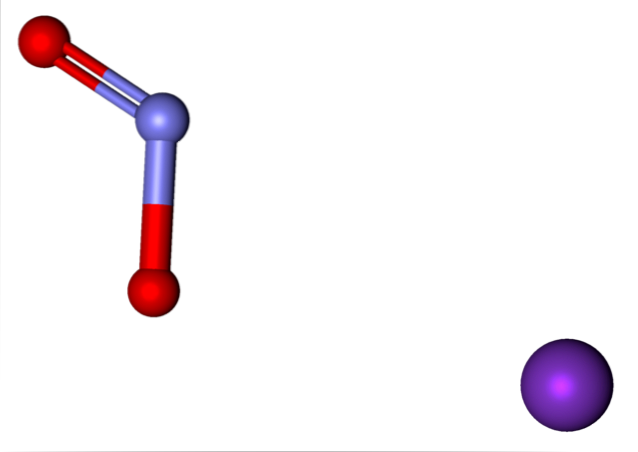
Ionene som er tilstede i kaliumnitrit er vist ovenfor. K-kationen+ tilsvarer den lilla sfæren, mens INGEN anionto- er representert av de blålige og røde kulene.
Anion NOto- vist med en dobbel og en enkelt binding [O = N-O]-; men i virkeligheten er begge bindinger like produkt av resonansen til den negative ladningen mellom dem.
K-ioner+ og neito- de tiltrekker hverandre i rommet til de organiserer et strukturelt mønster med minst energi; dette er hvor frastøting mellom like ladninger er minimal. Og slik lager de KNO-krystallerto, hvis enhetscelle er utsatt for temperaturendringer, hvilken fase overgår.
For eksempel ved lave temperaturer (under 25 ° C) KNO-krystallerto vedta et monoklinisk system (fase I). Når temperaturen overstiger 25 ° C, skjer en faseovergang fra monoklin til rombohedral (fase II). Til slutt, over 40 ° C, ble KNO-krystalleneto endre til å være kubikk (fase III).
Likeledes KNOto den kan utvise andre krystallinske faser (faser IV, V og VI) under høyt trykk. Med dette, K-ionene+ og neito- de ender med å bevege seg og bestille på forskjellige måter i sine rene krystaller.
Eiendommer
Molekylær masse
85,1038 g / mol.
Tetthet
1,9150 g / ml.
Smeltepunkt
440,02 ° C (men begynner å brytes ned fra 350 ° C og avgir giftige røyk).
Kokepunkt
537 ° C (eksploderer).
Vannløselighet
312 g / 100 g vann ved 25 ° C.
Deliquescence
Dens løselighet i vann er slik at den er hygroskopisk; så mye at den utviser delikatesse, absorberer nok fuktighet til å oppløse seg. Denne affiniteten for vann kan skyldes den energiske stabiliteten som K-ioner får+ når den er hydrert, samt en lav gitterenthalpi for KNO-krystallerto.
Krystaller kan absorbere vann uten å oppløse for å bli et hydrat, KNOtoHtoO. I hydratet finnes vannmolekylet som følger ionene, noe som modifiserer den krystallinske strukturen.
Dette hydratet (eller flere av dem) kan dannes under -9 ° C; Ved høyere temperaturer oppløses og hydrerer vannet ionene og deformerer krystallet.
Løselighet i andre løsningsmidler
Litt løselig i varme alkoholer, og veldig løselig i ammoniakk.
pH
6-9. Dens vandige løsninger er derfor alkaliske, siden anionen NOto- kan hydrolyseres.
Nomenklatur
Til KNOto det kan også navngis på andre måter. 'Kaliumnitrit' tilsvarer navnet på dette saltet i henhold til stamnomenklaturen; 'kaliumnitrit', i henhold til den systematiske nomenklaturen, der den eneste valensen av kalium, +1, er uthevet; og kaliumdioksonitrat (III), i henhold til den systematiske nomenklaturen.
Navnet 'kaliumdioksonitrat (III)' fremhever +3-valensen til nitrogenatomet. Selv om det er det mest anbefalte navnet av IUPAC for KNOto, 'kaliumnitritt' fortsetter å være det mest praktiske og lettest å huske.
Å skaffe
Den mest direkte måten å syntetisere den på, men med et lavere utbytte, er gjennom termisk nedbrytning av kaliumnitrat eller saltpeter ved 400 ° C eller mer:
2KNO3 => KNOto + ELLERto
Imidlertid en del av KNOto Det ender opp med å bli spaltet av varmen, i tillegg til at andre produkter blir dannet.
En annen metode for å fremstille eller syntetisere den med et høyere utbytte er ved å redusere KNO3 i nærvær av bly, kobber eller sink. Ligningen for denne reaksjonen er som følger:
KNO3 + Pb => KNOto + PbO
Kaliumnitrat og bly blandes støkiometrisk i en jernpanne, hvor de smelter under konstant omrøring og oppvarming i en halv time. Bly (II) oksyd er gul i fargen, og den resulterende massen pulveriseres varm og behandles med kokende vann. Deretter filtreres den varme blandingen.
Det varme filtratet bobles med karbondioksid i fem minutter, som vil utfelle blykarbonat, PbCO3, uoppløselig. På denne måten skilles blyet fra filtratet. Fortynnet salpetersyre tilsettes filtratet til pH er nøytralt, det får avkjøles, og til slutt fordampes vannet slik at KNO-krystallene dannes.to.
applikasjoner
Tilsetningsstoff og reagens
Kaliumnitrit brukes som tilsetningsmiddel for å kurere rødt kjøtt, og opprettholder smaken og fargen lenger under lagring, samtidig som bakterienes og visse giftstoffer, som botulinum, forsinkes. Derfor viser den antibakteriell virkning.
KNOto det oksiderer til NO, som reagerer med myoglobin i kjøtt og følgelig ender med å endre sin naturlige røde farge. Senere, når kjøttet er kokt, får det sin karakteristiske sterke rosa farge.
Imidlertid under betingelser uten å spesifisere KNOto reagerer med kjøttproteiner for å gi nitrosaminer, som kan bli kreftfremkallende.
På den annen side KNOto (men helst NaNOto) er et analytisk reagens som kan brukes i syntesen av azofargestoffer (reaksjonen av salpetersyre med aromatiske aminer), og i analysen av aminosyrer.
Motgift
Mens det har sine negative effekter, KNOto fungerer som motgift hos pasienter forgiftet med cyanider og hydrogensulfid. Dens mekanisme består av å oksidere Fe-sentreneto+ til tro3+ av gruppene har vi hemoglobiner, produserer methemoglobin, som deretter reagerer med CN-anionene- og HS-.
Leger
I magesaften i magen anionen NOto- det er redusert til NO, som er kjent for å ha en vasodilaterende virkning, noe som øker blodstrømmen. I andre deler av kroppen der pH ikke er sur nok, er noen enzymer, som xantinoksydoreduktase, ansvarlige for å redusere NOto-.
KNO har blitt bruktto å behandle plager og sykdommer som angina pectoris og epilepsi (med svært negative bivirkninger).
Referanser
- Wikipedia. (2019). Kaliumnitrit. Gjenopprettet fra: en.wikipedia.org
- PrebChem. (2016). Fremstilling av kaliumnitritt. Gjenopprettet fra: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Uorganisk nitrat og nitritt og kontroll av blodtrykk, kardiovaskulær forskning, bind 89, utgave 3, 15. februar 2011, sider 492-498, doi.org/10.1093/cvr/cvq309
- PubChem. (2019). Kaliumnitrit. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Kjemisk formulering. (2018). Kaliumnitrit. Gjenopprettet fra: formulacionquimica.com
- Nasjonalt senter for fremme av translasjonsvitenskap. (2011). Kaliumnitrit. Gjenopprettet fra: drugss.ncats.io
- Richard J. Epley, Paul B. Addis og Joseph J. Warthesen. (1992). Nitritt i kjøtt. University of Minnesota.
- N. R. Rao, B. Prakash og M. Natarajan. (1975). Krystallstrukturtransformasjoner i uorganiske nitritter, nitrater og karbonater. Institutt for kjemi, Indian Institute of Technology, Kanpur, India.


Ingen har kommentert denne artikkelen ennå.