
Natriumnitritt (NaNO2) struktur, egenskaper, bruksområder, risiko

De natriumnitritt er et krystallinsk uorganisk fast stoff dannet av et natriumion Na+ og et nitrittion NOto-. Den kjemiske formelen er NaNOto. Det er et hvitt krystallinsk fast stoff som har en tendens til å absorbere vann fra miljøet, det vil si det er hygroskopisk.
I nærvær av luft oksiderer den sakte til natriumnitrat NaNO3. Den har oksiderende egenskaper (den oksyderer andre forbindelser) og reduserer også egenskaper (den oksyderes av andre forbindelser).

Det er naturlig tilstede i menneskekroppen og brukes som konserveringsmiddel for spekemat og røkt fisk, da det forhindrer veksten av skadelige mikroorganismer..
Det har en viktig bruk i nødbehandlingen av cyanidforgiftning, siden det reduserer den giftige og dødelige effekten av denne forbindelsen. Imidlertid må den administreres med stor forsiktighet og fungerer ikke i alle tilfeller.
Det er funnet at det kan forhindre øyeinfeksjoner forårsaket av forurensning av kontaktlinser av mikroorganismer. Noen studier indikerer at forbruket av mat kan forårsake kreft, men det anslås at dette kan unngås ved å innta vitamin C sammen med slik mat..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3,5 Tetthet
- 3.6 Løselighet
- 3,7 pH
- 3.8 Andre egenskaper
- 4 Motta
- 4.1 Tilstedeværelse i kroppen
- 5 bruksområder
- 5.1 I næringsmiddelindustrien
- 5.2 Som nødbehandling ved cyanidforgiftning
- 5.3 For utvidelse av blodkar
- 5.4 Mot noen parasitter
- 5.5 For å unngå organskader
- 5.6 For å unngå infeksjoner på grunn av bruk av kontaktlinser
- 5.7 I forskjellige bruksområder
- 6 Risiko eller ulemper
- 7 Referanser
Struktur
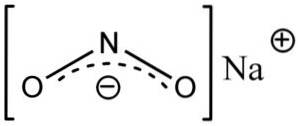
Natriumnitritt består av natriumkationen Na+ og nitrittanionet NOto-.
I nitrittanionet NOto- nitrogen har en valens på +3 og oksygen på -2, av denne grunn har anionen en global global ladning.
Nitrittanion NOto- har en vinkelstruktur, det vil si at bindinger av nitrogen (N) med oksygenatomer (O) danner en vinkel.
Nomenklatur
- Natriumnitritt
- Natriumnitritt
- Salpetersyre natriumsalt.
Eiendommer
Fysisk tilstand
Gulhvitt krystallinsk fast stoff. Ortorhombiske krystaller.
Molekylær vekt
68,995 g / mol
Smeltepunkt
271 ºC
Kokepunkt
Det koker ikke. Den brytes ned over 320 ºC
Tetthet
2,17 g / cm3 ved 20 ºC
Løselighet
Løselig i vann: 84,8 g / 100 g vann ved 25 ºC. Litt løselig i etanol. Moderat løselig i metanol. Lite oppløselig i dietyleter.
pH
De vandige løsningene er basiske, med en pH på ca. 9. Dette er fordi lystgass syre er en svak syre som ikke har en tendens til å løsne seg, så NO-ionetto- prøv å ta et proton H+ vann for å danne HNOto, som fører til dannelse av OH-ioner- som produserer alkalinitet.
IKKEto- + HtoO → HNOto + Åh-
Andre egenskaper
Sodium Nitrite NaNOto i nærvær av luft oksiderer sakte til natriumnitrat NaNO3. Det er et hygroskopisk fast stoff, siden det absorberer vann fra miljøet.
Den har oksiderende egenskaper (den kan oksidere andre forbindelser) og også reduserende egenskaper (den kan oksyderes av andre forbindelser).
Hvis den kommer i kontakt med materialer som tre, papir eller tekstiler, kan det føre til at de antennes farlig..
Med syrer spaltes det og genererer en blanding av brune giftige gasser av nitrogenoksider (NOx).
Å skaffe
Det kan oppnås ved oppvarming av natriumnitrat NaNO3 med bly Pb:
Eldre bror3 + Pb → NaNOto + PbO
Tilstedeværelse i kroppen
Nitrittanion er naturlig tilstede i blod og vev, da det dannes som et resultat av NO-oksidasjon..
applikasjoner
I næringsmiddelindustrien
Det brukes til å marinere kjøtt ettersom det fungerer som et fargestoff og retensjonsmiddel, og som et konserveringsmiddel når det kontrollerer veksten av mikroorganismer, og spesielt unngår utvikling av Clostridium botulinum forårsaker botulisme sykdom.
Natriumnitritt i kjøtt reagerer med hemoglobin i røde blodlegemer eller røde blodlegemer i denne maten. Brukes også i speket røkt fisk.

Som en nødbehandling for cyanidforgiftning
Natriumnitritt brukes til å behandle akutt cyanidforgiftning. Det er en motgift mot dette alvorlige problemet.
Virkningen skyldes at den favoriserer dannelsen av methemoglobin (en type hemoglobin) i blodet, som fanger cyanidioner og ikke frigjør dem, og dermed forhindrer dem fra å bli frigitt i celler, noe som gjør dem mindre giftige.
I tilfelle cyanidforgiftning påføres natriumnitrit intravenøst, og det tar omtrent 12 minutter å generere metemoglobin. Til tross for denne forsinkelsen, gir den også beskyttelse på grunn av dens vasodilaterende effekt..
For utvidelse av blodkar
Det brukes til å behandle pulmonal arteriell hypertensjon ettersom det virker ved å utvide blodkarene, og dermed senke blodtrykket. Det er anslått at denne effekten skyldes at den transformeres til nitrogenoksid NO som virker ved å slappe av de myke musklene..
Årsakene til effektiviteten er imidlertid fortsatt under utredning..
Mot noen parasitter
Enkelte forskere fant at natriumnitritt hemmer veksten og formeringen av tarmparasitten Blastocystis hominis selv om det er motstandsdyktig mot andre medisiner.
NaNO ble funnetto genererer død av denne parasitten ved apoptose, som er en slags selvmord på parasittcellen. Natriumnitritt får tarmcellene til å produsere NO, noe som ser ut til å være viktig i denne prosessen.
For å unngå organskader
I følge noen studier er nitritt en kraftig hemmer for skade på hjerte og lever i iskemiske prosesser (redusert blodstrøm i en del av kroppen). Dette antas å skyldes at det er en biologisk reserve av NO.
Det ble konkludert med at det kan brukes til å forhindre organskader etter å ha gjenopprettet blodstrømmen som har blitt avbrutt av et hjerteinfarkt, høyrisiko abdominal kirurgi eller en organtransplantasjon..
For å unngå infeksjoner fra å bruke kontaktlinser
NaNO er funnetto forhindrer dannelsen av filmer av patogene mikroorganismer Staphylococcus aureus Y Pseudomonas aeruginosa om kontaktlinser.

I forskjellige bruksområder
Natriumnitritt brukes til å lage fargestoffer, medisiner og forskjellige organiske forbindelser.
Fungerer også som korrosjonshemmere i universalfett.
Risiko eller ulemper
Et av problemene med bruk av natriumnitritt for cyanidforgiftninger er at det forårsaker alvorlige kardiovaskulære lidelser hos barn..
Ikke anbefalt for brannofre der samtidig eksponering for både cyanid og karbonmonoksid (CO) forekommer. CO reduserer blodets evne til å bære oksygen, så administrering av NaNOto vil forverre den lave oksygentilstanden i pasientens blod.
Inhalert natriumnitritt er irriterende og giftig, det kan skade kardiovaskulærsystemet og sentralnervesystemet. I tillegg er det skadelig for miljøet.
Natriumnititt inntatt med mat kan være skadelig. Når nitritt når magen, reagerer det med visse forbindelser som danner nitrosaminer, noe som kan forårsake kreft.
Disse reaksjonene kan unngås i nærvær av vitamin C.
I følge visse kilder som er konsultert, er risikoen for å konsumere nitritter med spekemat eller fisk minimal fordi nitritt er naturlig tilstede i spytt.
Kildene indikerer at denne risikoen også er minimal sammenlignet med de store fordelene ved å konsumere mat uten skadelige mikroorganismer.
Referanser
- Bhattacharya, R. og Flora, S.J.S. (2015). Cyanid toksisitet og dets behandling. I Handbook of Toxicology of Chemical Warfare Agents (Second Edition). Gjenopprettet fra sciencedirect.com.
- OSS. National Library of Medicine. (2019). Natriumnitritt. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Kim, D.J. et al. (2017). Antibiofilm-effekten av nitrogenoksid på myke kontaktlinser. BMC Ophthalmol 17, 206 (2017). Gjenopprettet fra bmcophthalmol.biomedcentral.com.
- Ramis-Ramos, G. (2003). Antioksidanter. Syntetiske antioksidanter. I Encyclopedia of Food Sciences and Nutrition (Andre utgave). Gjenopprettet fra sciencedirect.
- Barozzi Seabra, A. og Durán, N. (2017). Nitrogenoksydgivere for behandling av forsømte sykdommer. I nitrogenoksydgivere. Gjenopprettet fra sciencedirect.com.
- Duranski, M.R. et al. (2005). Cytoprotektive effekter av nitritt under in vivo iskemi-reperfusjon av hjerte og lever. J Clin Invest 2005; 115 (5): 1232-1240. Gjenopprettet fra ncbi.nlm.nih.gov.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.

Ingen har kommentert denne artikkelen ennå.