
Ikke-metallhistorie, egenskaper, grupper, bruksområder
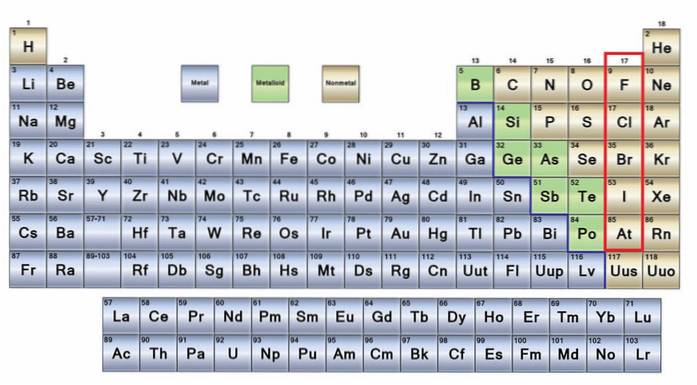
De ingen metaller De er en gruppe av elementer som er plassert på høyre side av det periodiske systemet, med unntak av hydrogen som ligger i gruppe 1 (IA), sammen med alkalimetallene. Hvis du vil vite hva de er, må du se i øvre høyre hjørne av p-blokken.
Ikke-metalliske atomer er relativt små, og deres ytre elektroniske skall har et høyt antall elektroner. Blant de ikke-metalliske elementene kan være faste stoffer, væsker og gasser; selv om de fleste av dem er i gassform, beriker flere av dem atmosfæren.
En god del av ikke-metaller er til stede i alle levende vesener i form av forbindelser og makromolekyler. For eksempel: karbon, oksygen og hydrogen er til stede i alle proteiner, lipider, karbohydrater og nukleinsyrer.
Fosfor er tilstede i alle nukleinsyrer og i noen karbohydrater og lipider. Svovel finnes i mange proteiner. Nitrogen er en del av alle nukleinsyrer og proteiner.
På den annen side består underjordiske metangasser og råolje nesten utelukkende av ikke-metalliske elementer. Faktisk gir hydrokarboner (karbon og hydrogen) en ide om hvor rikelig ikke-metaller er til tross for deres lavere antall elementer i det periodiske systemet..
Artikkelindeks
- 1 Historie
- 2 Fysiske og kjemiske egenskaper
- 2.1 Fysikk
- 2.2 Kjemi
- 3 grupper av ikke-metaller og grunnstoffer
- 3.1 Gruppe 1
- 3.2 Gruppe 14
- 3.3 Gruppe 15
- 3.4 Gruppe 16
- 3.5 Gruppe 17
- 3.6 Gruppe 18
- 4 bruksområder
- 4.1 Hydrogen
- 4.2 Karbon
- 4.3 Nitrogen
- 4.4 Fosfor
- 4.5 Oksygen
- 4.6 Svovel
- 4.7 Selen
- 4.8 Fluor
- 4.9 Klor
- 4.10 Brom
- 4.11 Jod
- 4.12 Helium
- 4.13 Neon
- 4.14 Argon
- 4.15 Xenon
- 4.16 Radon
- 5 Referanser
Historie
Siden eldgamle tider (3750 f.Kr.) brukte egypterne kull for å redusere kobber som var tilstede i mineralene deres, som korvellitt og malakitt.
I 1669 lyktes Hennin Brand i å isolere fosfor fra samlet urin. Henry Cavendish (1776) lyktes i å identifisere hydrogen, selv om flere forskere, inkludert Robert Boyle (1670), produserte hydrogen ved å reagere en sterk syre med et metall.
Carl Scheele produserte oksygen ved oppvarming av kvikksølvoksid med nitrater (1771). Curtois klarte å isolere jod, mens han prøvde å forberede saltpeter fra tang (1811). Balard og Gmelin isolert brom (1825).
I 1868 oppdaget Janssen og Lockger uavhengig helium ved å observere en gul linje i studiet av solspekteret som ikke tilhørte et annet element. Moissan lyktes i å isolere fluor (1886).
I 1894 oppdaget Lord Rayleigh og Ramsey argon ved å studere nitrogenens egenskaper. Ramsay og Travers (1898) isolerte krypton, neon og xenon fra flytende argon ved kryogen destillasjon av luft..
Fysiske og kjemiske egenskaper

Fysisk
Noen av de fysiske egenskapene til ikke-metaller er:
-De har lav elektrisk ledning, bortsett fra karbon i form av grafitt, som er en god leder av elektrisitet..
-De kan vises under det fysiske utseendet til faste stoffer, væsker eller gasser.
-De har lav varmeledningsevne, bortsett fra karbon i form av diamant, som ikke oppfører seg som en termisk isolator..
-De har lav glans, i motsetning til den metalliske glansen av metaller.
-Ikke-metalliske faste stoffer er sprø, så de er ikke duktile eller formbare.
-De har lave smelte- og kokepunkter.
-De kan ha forskjellige krystallinske strukturer. Dermed har fosfor, oksygen og fluor en kubisk krystallinsk struktur; hydrogen, karbon og nitrogen, sekskantet; og svovel, klor, brom og jod, ortorombisk.
Kjemi
Ikke-metaller er preget av å ha høy ioniseringsenergi og høy elektronegativitetsverdi. Fluor har for eksempel den høyeste elektronegativiteten (3,98), og er det mest reaktive elementet i ikke-metallene.
Men overraskende nok har edelgassene helium (5.5) og neon (4.84) den høyeste elektronegativiteten. Imidlertid er de kjemisk inerte fordi de ytre elektroniske skallene er fylt..
Ikke-metaller danner ioniske forbindelser med metaller og kovalente med ikke-metaller.
Ikke-metalliske elementer er funnet å danne diatomiske molekyler, bundet av kovalente bindinger. I mellomtiden er atomer av edelgasser i form av atomenheter.
De danner sure oksider som, når de reagerer med vann, gir syrer.
Ikke-metalliske grupper og elementer
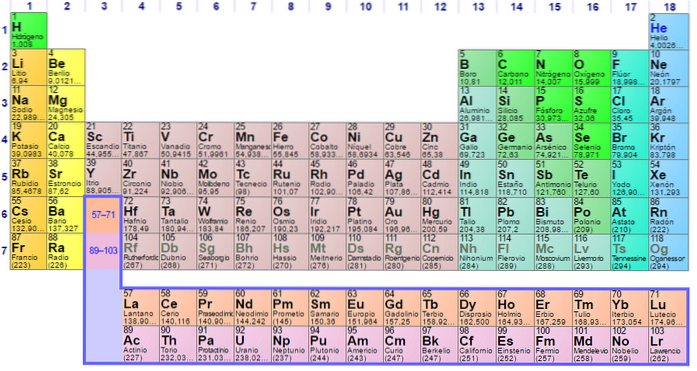
Gruppe 1
Den består av hydrogen, en fargeløs og luktfri gass, diatomisk. Oksidasjonstilstand +1. Den har lavere tetthet enn luft. I fast tilstand har den en sekskantet krystallinsk struktur. Hydrogen er et dårlig reaktivt element.
Gruppe 14
Karbon er det eneste ikke-metall i denne gruppen. Karbon i form av grafitt er et skinnende fast stoff med en sekskantet krystallinsk struktur. Den har høy elektrisk ledningsevne. Dens vanligste oksidasjonstilstander er +2 og +4.
Gruppe 15
Nitrogen
Fargeløs og luktfri gass. Det er et litt reaktivt element og litt tettere enn luft. Vanligste oksidasjonsstatus: -3 og +5. Danner diatomiske molekyler, Nto.
Kamp
Solid, fargen kan være hvit, gul eller svart. Lite reaktivt. Ortorhombisk krystallstruktur. Elektronegativitet 2.1. Vanligste oksidasjonstilstander: -3 og +5.
Gruppe 16
Oksygen
Fargeløs eller lyseblå gass, luktfri. Vanligvis ikke-reaktive. Kubisk krystallstruktur. Det er en isolator og et sterkt oksidasjonsmiddel. Elektronegativitet 3.5. Oksidasjonstilstand -2
Svovel
Strålende gult fast stoff, sprøtt, moderat reaktivt. Ortorhombisk krystallstruktur. Danner kovalente bindinger. Elektronegativitet 2.5. De vanligste oksidasjonstilstandene: -2, +2, +4 og +6.
Selen
Ensfarget grå eller rød til svart. Grå selen har lysfølsom elektrisk ledningsevne. Det er et mykt og sprøtt fast stoff. Elektronegativitet 2.4. Oksidasjonstilstander: -2, +2, +4 og +6.
Gruppe 17
Fluor
Det er en lysegul gass, veldig giftig. Det er et veldig reaktivt element. Det forekommer som diatomiske molekyler, Fto. I fast tilstand krystalliserer den seg i kubisk form. Elektronegativitet 3.98. Oksidasjonstilstander -1.
Klor
Det er en grønn-gul gass. Den presenterer diatomiske molekyler, Clto. Det er veldig reaktivt. I fast tilstand er den krystallinske strukturen ortorombisk. Elektronegativitet 3.0. Oksidasjonstilstander: - 1, +1, +3, +5, +7.
Brom
Det er en rødbrun væske. Elektronegativitet 2.8. Oksidasjonstilstander -1, +1, +3, +5 og +7.
Jod
Det er et svart fast stoff som når sublimert avgir en fiolett damp. Ortorhombisk krystallstruktur. Metalljodider er ioniske. Elektronegativitet 2.5. Oksidasjonstilstander: -1, +1, +3, +5 og +7.
Astatus
Det er en solid svart. Ansiktssentrert kubisk krystallstruktur. Elektronegativitet 2.2. Det er et svakt oksidasjonsmiddel.
Gruppe 18
Helium
Den har høy varmeledningsevne. Elektronegativitet 5.5. Det er kjemisk inert og ikke brannfarlig. Lav tetthet og høy flyt.
Neon
Høy kjølekapasitet i flytende tilstand. Elektronegativitet 4,84. Det er den minst reaktive av edelgassene.
Argon
Det er tettere enn luft. Kjemisk inert. Elektronegativitet 3.2.
Krypton
Elektronegativitet 2,94. Kan reagere med fluor for å danne kryptondifluorid (KrFto).
Xenon
Den krysser blod-hjerne-barrieren. Den reagerer på elektrisk strøm ved å produsere lys. Elektronegativitet 2.2. Danner komplekser med fluor, gull og oksygen.
Radon
Det er et radioaktivt element. Elektronegativitet 2.06. Danner forbindelser med fluor (RnFto) og med oksygen (RnO3).
applikasjoner
Hydrogen
Den brukes i rakettfremdrift og som drivstoff i bilmotorer som bruker hydrogen. Den brukes i syntesen av ammoniakk (NH3) og i hydrogenering av fett.
Karbon

Grafitt brukes til fremstilling av blyanter og høyfaste fibre som brukes til produksjon av sportsutstyr. Diamant brukes som en perle av stor verdi og i borehull som et slipemiddel. Karbondioksid brukes i produksjonen av kullsyreholdige drikker.
Nitrogen
Det brukes i produksjonen av ammoniakk, salpetersyre og urea. Nitrogen er et viktig element for planter og brukes til fremstilling av gjødsel.
Kamp
Hvit fosfor brukes som et rodenticid, insektmiddel og i fyrverkeriindustrien. Rød fosfor brukes til å lage fyrstikker. Dens forbindelser brukes også til produksjon av gjødsel.
Oksygen
Oksygen brukes til fremstilling av stål, plast og tekstiler. Den brukes også i rakettdrivmidler, oksygenbehandling og pustehjelp i fly, ubåter og romfart..
Svovel
Det brukes som råmateriale for produksjon av svovelsyre, krutt og i vulkanisering av gummi. Sulfitter brukes til å bleke papir og i soppdrepende middel.
Selen
Den brukes til å gi glass en skarlagenrød fargetone. Det brukes også til å nøytralisere det grønne skjæret som produseres ved forurensning av glasset med jernforbindelser. Den brukes i fotoelektriske celler med applikasjon i dører og heiser.
Fluor

Det tilsettes tannkremer for å forhindre hulrom. Hydrogenfluorid brukes som råstoff til teflon. Monatomisk fluor brukes til fremstilling av halvledere.
Klor
Den brukes i ekstraksjonsmetallurgi og i klorering av hydrokarboner for fremstilling av forskjellige produkter som PVC. Klor brukes i tremasse og blekemidler i tekstil. Det brukes også som vanndesinfeksjonsmiddel.
Brom
Den brukes til fremstilling av sølvbromid til lysfølsomme linser og i fotografisk film. Den brukes også til fremstilling av beroligende natriumbromid og dibrometan, en antiknokomponent i bensin.
Jod
Kaliumjodid (KI) tilsettes for å forhindre skjoldbruskkjertel. Tinktur av jod brukes som et antiseptisk middel og bakteriedrepende middel. Jod er en del av skjoldbruskhormonene.
Helium
Den brukes til å fylle luftballonger og blandes med oksygen for å puste dypt vann. Den brukes til sveising i en inert atmosfære, og hjelper også til å opprettholde svært lave temperaturer i forskning.
Neon
I glassrør som er opplyst av kraftens virkning (røde neonlys).
Argon
Brukes til å skape en atmosfære for sveising og når du fyller glødepærer.
Xenon
En blanding av xenon og krypton brukes til å produsere blink med høy intensitet i korte fotografiske eksponeringer.
Radon
Det brukes til behandling av kreftsvulster ved strålebehandling.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. og Ahern, K. G. (2002). Biokjemi. Tredje utgave. Redigere. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (6. oktober 2019). Hva er egenskapene til ikke-metaller? Gjenopprettet fra: thoughtco.com
- Wikipedia. (2019). Ikke-metallisk. Gjenopprettet fra: en.wikipedia.org
- Redaksjonen av Encyclopaedia Britannica. (5. april 2016). Ikke-metallisk. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- José M. Gavira Vallejo. (2016, 27. januar). Hva er de polygene elementene? Og icosagens, crystallógens, chalcogens ...? Gjenopprettet fra: triplenlace.com



Ingen har kommentert denne artikkelen ennå.