
Natriumoksalat (Na2C2O4) struktur, egenskaper, bruksområder, risiko
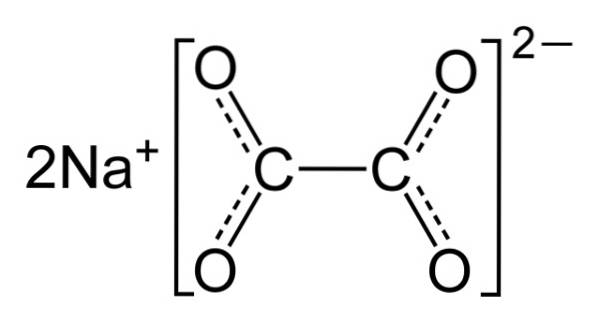
De natriumoksalat Det er en organisk forbindelse som består av to natriumioner og ett oksalation. Den kjemiske formelen er NatoCtoELLER4 eller også Nato(COO)to. Det er natriumsaltet av oksalsyre eller etandisyre. Deretter entoCtoELLER4 er et hvitt krystallinsk fast stoff og dets vandige oppløsninger er basiske (alkaliske).
Natriumoksalat er tilstede i planter og grønnsaker. Hos mennesker genereres oksalsyre naturlig fra sin konjugerte syre, som igjen produseres av visse metabolske prosesser.

Deretter entoCtoELLER4 Den brukes i kjemiske analyselaboratorier som et reduksjonsmiddel (motsatt av oksidant). Også for å tillate testing av visse organiske forbindelser under avløpsrensing.
Det har blitt brukt til avhending av klorfluorkarboner (CGC), som skader ozonlaget. Det er også et råmateriale for å oppnå oksalsyre økonomisk.
På grunn av det høye natriumoksalatinnholdet i noen spiselige grønnsaker, bør folk som har en tendens til å danne steiner eller nyrestein unngå å konsumere slik mat. Dette er fordi steinene vanligvis er dannet med oksalater..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Tetthet
- 3.4 Løselighet
- 3,5 pH
- 3.6 Kjemiske egenskaper
- 4 Motta
- 4.1 Tilstedeværelse i naturen
- 5 bruksområder
- 5.1 I kjemiske analyselaboratorier
- 5.2 Ved destruksjon av klorfluorkarboner
- 5.3 Ved bestemmelse av viktige parametere i avløpsrensing
- 5.4 For å oppnå oksalsyre
- 5.5 For å fjerne uønskede forbindelser
- 6 Risiko
- 7 Referanser
Struktur
Natriumoksalat består av to natriumkationer Na+ og et oksalatanion (COO)toto-. Oksalatanionet består i sin tur av to COO-enheter- bundet gjennom de to karbonatomer: -OOC-COO-.
I fast natriumoksalat har oksalatanionen en flat form. Dette betyr at både karbon og oksygene er i samme plan..
Nomenklatur
- Natriumoksalat
- Dinatriumoksalat
- Etandiosyre natriumsalt
Eiendommer
Fysisk tilstand
Solid hvit krystallinsk.
Molekylær vekt
134,0 g / mol
Tetthet
2,27 g / cm3 ved 20 ° C.
Løselighet
Løselig i vann: 3,7 g / 100 ml ved 20 ° C.
pH
De vandige løsningene er basiske (alkaliske) fordi oksalatanionen har en tendens til å ta protoner fra vannet og etterlate OH-ionene fri.-.
Kjemiske egenskaper
Det kan nøytralisere syrer, og reaksjonene er eksoterme, det vil si at de gir fra seg varme.
Det fungerer som et reduksjonsmiddel og genererer i disse reaksjonene karbondioksid COto.
Den har egenskapen til å binde seg sterkt til forskjellige metallioner som jernholdige jernioner Feto+ og ferri Fe3+.
Å skaffe
I følge en konsultert kilde kan natriumoksalat oppnås ved å oksidere karbon med oksygen Oto ved en temperatur på ca. 250 ° C i en konsentrert løsning av natriumhydroksyd NaOH.
Tilstedeværelse i naturen
Natriumoksalat er til stede i mange planter og grønnsaker, som chard, spinat og rabarbra, og i korn som soyabønner, blant mange andre planteprodukter..

Den konjugerte syren, oksalsyre, produseres i menneskekroppen ved metabolismen av glykolsyre eller askorbinsyre. Når den er produsert, metaboliseres den ikke, men skilles ut i urinen i form av oksalat..

applikasjoner
I kjemiske analyselaboratorier
Det brukes som et kjemisk reagens, vanligvis som et reduksjonsmiddel, for eksempel for standardisering av kaliumpermanganatløsninger, det vil si for å bestemme nøyaktig hvor mye natriumpermanganat de har.
Ved ødeleggelse av klorfluorkarboner
Natriumoksalat har blitt brukt til destruksjon av klorfluorkarboner (CFC). Disse CFC-forbindelsene har vært en av de som er ansvarlige for ødeleggelsen av planetens ozonlag (som beskytter oss mot ultrafiolett stråling).
I 1996 foreslo noen forskere bruk av natriumoksalat for å eliminere dem, da det lett reagerer med CFC ved temperaturer på 270-290 ° C, noe som gjør dem ufarlige for ozonlaget..
Reaksjonen av natriumoksalat med CFC kan kontrolleres for å oppnå halogenerte aromatiske hydrokarboner som ikke er skadelige for ozonlaget, men som er nyttige forbindelser i den kjemiske industrien..
Nevnte reaksjon kan også maksimeres og omdanne all CFC til natriumfluorid NaF, natriumklorid NaCl, elementært karbon og karbondioksid CO.to.

Ved bestemmelse av viktige parametere i avløpsrensing
Natriumoksalat har vist seg å være nyttig for å måle mengden og typer organiske forbindelser som utskilles av mikroorganismer fra slam som brukes til å behandle avløpsvann..
Måling av slike forbindelser er viktig for å bestemme deres funksjon under behandling av avløpsvann, siden det er enkelt å skille slammet fra vannet avhengig av dem..
Bruk av natriumoksalat unngår ulempene ved andre metoder.
For å oppnå oksalsyre
Rått natriumoksalat fra visse prosessavfall har blitt brukt til å produsere oksalsyre HtoCtoELLER4 i store mengder.
Metoden bruker slam fra Bayer-prosessen for å behandle bauxitt (en aluminiummalm). I Bayer-prosessen behandles bauxitt med natriumhydroksyd NaOH for å oppløse aluminiumoksydet av dette mineralet.
I løpet av oppløsningen av aluminiumoksyd blir visse organiske forbindelser som er tilstede i mineralet, for eksempel humussyrer, angrepet av NaOH, og genererer en stor mengde natriumoksalat NatoCtoELLER4.
Dette natriumoksalatet er innlemmet i et gjørme med aluminiumforbindelser. For å rense det oppløses det, filtreres og føres gjennom en syre-type ionebyttekolonne..
I kolonnen er en sulfonsyreharpiks RSO3H hvor metallioner byttes ut Na+ av hydrogenioner H+, slik at du får oksalsyre HtoCtoELLER4.
RSO3H + NatoCtoELLER4 ⇔ RSO3Na + NaHCtoELLER4
RSO3H + NaHCtoELLER4 ⇔ RSO3Na + HtoCtoELLER4
Dette er en billig prosess, og den oppnådde oksalsyren er av akseptabel renhet..
For å fjerne uønskede forbindelser
Konjugert syre av natriumoksalat, oksalsyre HtoCtoELLER4, brukes til å oppløse visse typer rusk og avskalling.
Det utnytter egenskapen til oksalsyre å konvertere til oksalat som fungerer som et kompleksdannende eller utfellende middel, for eksempel under behandling av avfall fra forskjellige kjernebrensler.
Oksalsyre brukes også til å fjerne mineralskala og jernoksider i rør og annet utstyr, dette skyldes dens evne til å binde både jernholdig Fe Feto+ med hensyn til jernion Fe3+ danner oksalater.
Risiko
Hvis direkte innåndet eller inntatt natriumoksalat forårsaker smerter i halsen, spiserøret og magen. Produserer oppkast, alvorlig rensing, svak puls, kardiovaskulær kollaps, nevromuskulære symptomer og nyreskader.
Personer som har en tendens til å danne nyrestein på grunn av opphopning av oksalat i urinen, bør unngå å konsumere grønnsaker med høyt innhold av løselige oksalater som natrium.
Natriumoksalat i store mengder mat når det når urinen, binder seg til kalsiumet som er tilstede i det og kan forårsake steiner eller kalsiumoksalatstein i nyrene hos mennesker som har en tendens til å gjøre det..
Referanser
- OSS. National Library of Medicine. (2019). Natriumoksalat. Nasjonalt senter for bioteknologisk informasjon. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Chai, W. og Liebman, M. (2005). Effekt av forskjellige tilberedningsmetoder på vegetabilsk oksalatinnhold. J. Agric. Food Chem.2005, 53, 3027-3030. Gjenopprettet fra pubs.acs.org.
- Dagani, R. (1996). CFC Destroying Reaction. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Gjenopprettet fra pubs.acs.org.
- Sajjad, M. og Kim, K.S. (2016). Ekstraksjon av ekstracellulære polymere stoffer fra aktivert slam ved bruk av natriumoksalat. Int. J. Environ. Sci. Technol. 13, 1697-1706 (2016). Gjenopprettet fra link.springer.com.
- Jeffrey, G.A. og Parry, G.S. (1954). Krystallstrukturen av natriumoksalat. J. Am. Chem. Soc. 1954, 76, 21, 5283-5286. Gjenopprettet fra pubs.acs.org.
- Okuwaki, A. et al. (1984). Produksjon av oksalat ved oksidering av kull med oksygen i en konsentrert natriumhydroksydløsning. Ind. Eng. Chem. Prod. Res. Dev. 1984, 23, 648-651. Gjenopprettet fra pubs.acs.org.
- Hefter, G. et al. (2018). Løselighet av natriumoksalat i konsentrerte elektrolyttløsninger. J Chem & Eng Data. 2018, 63, 3, 542-552. Gjenopprettet fra pubs.acs.org.
- The, K. I. (1992). Fremgangsmåte for fremstilling av oksalsyre og natriumhydrogenoksalat fra rå natriumoksalat. OSS. Patent nr. 5 171 887. 15. desember 1992. Gjenopprettet fra freepatentsonline.com.



Ingen har kommentert denne artikkelen ennå.