
Natriumperoksyd (Na2O2) struktur, egenskaper, bruksområder

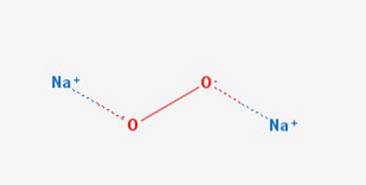
De natriumperoksid er en kjemisk forbindelse med formel NatoELLERto Den har to ioniske bindinger mellom de to natriumatomene og O2-molekylet. Den finnes i forskjellige hydrater og peroksyhydrater inkludert NatoELLERto 2HtoELLERto 4HtoPå entoELLERto 2HtoPå entoELLERto 2HtoELLERto og NatoELLERto 8HtoELLER.
Den har en sekskantet krystallinsk struktur, men ved oppvarming gjennomgår denne formen en overgang til en fase med ukjent symmetri ved 512 ° C.Den krystallinske strukturen er vist i figur 2 (Sodium: sodium peroxide, 1993-2016).

Natriumperoksyd kan fremstilles i stor skala ved å reagere metallisk natrium med oksygen ved 130-200 ° C (Ashford, 1994), en prosess som genererer natriumoksid, som i et separat trinn absorberer oksygen:
4 Na + Oto → NatoELLER
2 NatoO + Oto → 2 NatoELLERto
Den foreliggende batch-prosessen involverer oksidasjon av natrium i natriummonoksyd med tørr luft og påfølgende oksidasjon av monoksidet i peroksyd med 90% oksygen..
I 1951 begynte USI å drive den første kontinuerlige prosessen for produksjon av natriumperoksid. Prosessen er unik på én måte: den bruker luft i stedet for rent oksygen.
Variasjoner av en batchprosess har blitt brukt i nesten 70 år (SCHOW, 1957), for eksempel inneholder det kommersielle produktet mellom 90 og 95% hydrogenperoksid.
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper av natriumperoksid
- 2 Reaktivitet og farer
- 3 bruksområder
- 4 Referanser
Fysiske og kjemiske egenskaper av natriumperoksid
Sodium peroxide er et gulaktig, granulært fast stoff som blir gult i kontakt med atmosfæren (National Center for Biotechnology Information, S.F.). Utseendet deres er illustrert i figur 3.

Natriumperoksyd har en molekylvekt på 77,98 g / mol og en tetthet på 2,805 g / ml. Forbindelsen har et smeltepunkt på 460,00 ° C hvor den begynner å spaltes til natriumoksyd og molekylært oksygen i henhold til reaksjonen:
2 Na2O2 → 2 Na2O + O2
Kokepunktet er 657 ° C (Royal Society of Chemistry, 2015).
Natriumperoksid reagerer voldsomt med reduksjonsmidler, brennbare materialer og lette metaller. Reagerer eksotermt og raskt eller til og med eksplosivt med vann for å danne en sterk base (NaOH) og oksygen (O2).
En blanding med ammoniumpersulfat kan eksplodere hvis den utsettes for friksjon (sliping i mørtel), hvis den blir oppvarmet, eller hvis en strøm av karbondioksydgass føres over den..
Reagerer veldig kraftig med hydrogensulfidgass. Selv i fravær av luft kan reaksjonen ledsages av en flamme. En eksplosjon oppstår når karbondioksydgass ledes over en blanding av natriumperoksid og magnesiumpulver..
Blandinger med eddiksyre eller eddiksyreanhydrid kan eksplodere hvis de ikke blir kaldt. De er spontant brannfarlige i kontakt med anilin, benzen, dietyleter eller organiske materialer som papir og tre..
Blandes med kull, glyserin, visse oljer og fosfor brenner eller eksploderer. En blanding med kalsiumkarbid (pulver) kan briste i flammer når den utsettes for fuktig luft og eksplodere ved oppvarming.
Den spaltes, ofte voldsomt i nærvær av katalytiske mengder mangandioksid. Blandingen med svovelmonoklorid fører til en voldsom reaksjon. Det kan reagere og forårsake antenning av drivstoff (SODIUM PEROXIDE, 2016).
Reaktivitet og farer
Natriumperoksid er en forbindelse klassifisert som en sterk base, eksplosiv og sterk oksidasjonsmiddel basert på reaktivitetsalarm. Blandinger med brennbart materiale antennes lett av friksjon, varme eller kontakt med fuktighet.
Kan spaltes kraftig ved langvarig eksponering for varme og føre til at beholdere som inneholder den knekker.
Svært farlig ved hud- og øyekontakt (irriterende) og ved inntak og innånding. Langvarig eksponering kan forårsake forbrenning og sår i huden. Overeksponering ved innånding kan forårsake irritasjon av luftveiene..
Betennelse i øyet er preget av rødhet, vanning og kløe. Betennelse i huden er preget av kløe, avskalling, rødhet eller av og til blemmer.
I tilfelle øyekontakt, bør du sjekke om du bruker kontaktlinser og fjerne dem. Øyene skal skylles straks med rennende vann i minst 15 minutter, og øyelokkene holdes åpne..
Ved hudkontakt vaskes den forurensede huden forsiktig og forsiktig med rennende vann og ikke-slipende såpe. Kaldt vann kan brukes. Irritert hud skal dekkes med et mykgjørende middel.
Hvis hudkontakten er alvorlig, bør den vaskes med et desinfiserende såpe og dekke forurenset hud med en antibakteriell krem..
Ved innånding skal offeret få hvile i et godt ventilert område..
Evakuer offeret til et trygt område så snart som mulig. Løsne stramme klær som en skjortekrage, belte eller slips. Hvis det er vanskelig å puste, gi oksygen. Hvis offeret ikke puster, må du utføre gjenoppliving fra munn til munn.
Ved svelging skal oppkast ikke induseres. Hvis offeret ikke puster, må du utføre gjenoppliving fra munn til munn.
I alle tilfeller, søk øyeblikkelig legehjelp (Material Safety Data Sheet Sodium peroxide, 2013).
applikasjoner
Natriumperoksid brukes i klærblekemiddel, da det reagerer med vann for å produsere hydrogenperoksid, et blekemiddel i henhold til reaksjonen:
NatoELLERto + 2 timertoO → 2 NaOH + HtoELLERto
I tillegg til hydrogenperoksid produserer reaksjonen natriumhydroksid (lut), som holder løsningen alkalisk. Varmt vann og en alkalisk løsning er begge nødvendige for at hydrogenperoksid skal fungere best som blekemiddel (Field, S.F.).
Natriumperoksid brukes til å bleke tremasse for produksjon av papir og tekstiler. Den brukes i dag primært til spesialiserte laboratorieoperasjoner, for eksempel mineralekstraksjon. I tillegg brukes natriumperoksyd som et oksidasjonsmiddel i kjemiske reaksjoner..
Det brukes også som en oksygenkilde ved å reagere det med karbondioksid for å produsere oksygen og natriumkarbonat, derfor er det spesielt nyttig i dykkerutstyr, ubåter osv. (Bruk av natriumperoksid til å skrubbe karbondioksidutslipp, 2014).
Referanser
- Ashford, R. (1994). Ashford's Dictionary of Industrial Chemicals. London: Publications Ltd.
- Field, S. (S.F.). Ingredienser -Natriumperoksid. Hentet fra sci-toys.com.
- Sikkerhetsdatablad Sodium peroxide. (2013, 21. mai). Hentet fra sciencelab.com.
- Nasjonalt senter for bioteknologisk informasjon. (S.F.). PubChem Compound Database; CID = 14803. Hentet fra PubChem.
- Royal Society of Chemistry. (2015). Natriumperoksid. Hentet fra chemspider.com.
- SCHOW, H. R. (1957). Sodium Peroxide Production Story. Fremskritt i kjemi, bind 19, 118-123.
- NATRIUMPEROXID. (2016). Hentet fra komokjemikalier.
- Natrium: natriumperoksid. (1993-2016). Hentet fra nettelementer.
- Bruk av natriumperoksid til å skrubbe utslipp av karbondioksid. (2014, 10. november). Hentet fra stackexchange.


Ingen har kommentert denne artikkelen ennå.