
Aniondannelse, egenskaper og typer
EN anion Det er en hvilken som helst kjemisk art med negativ ladning, i tillegg til å være en av de to typene eksisterende ioner. Den negative ladningen stammer fra det faktum at den har et overskudd av elektroner i forhold til artenes nøytrale form; for hvert ekstra elektron øker den negative ladningen med en enhet.
Den negative ladningen kan være lokalisert i ett eller flere atomer, samt inkludere dens innflytelse på et molekyl som helhet. For enkelhets skyld, uansett hvor ladningen er (-), betraktes hele arten, forbindelsen eller molekylet som et anion..
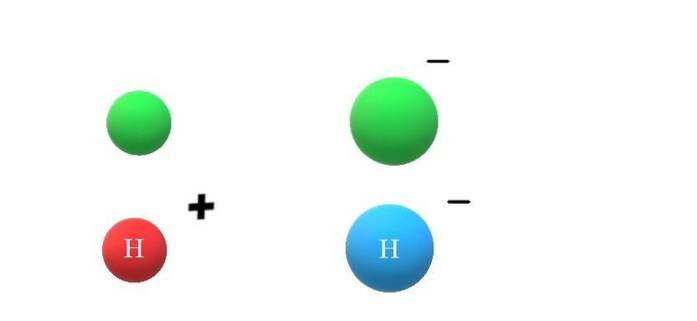
Hvis en nøytral art X får et elektron, vil de overskytende negative ladningene manifestere seg i dannelsen av anionet X-, som også vil føre til en økning i atomradiusen (øvre bilde, med grønne kuler). X og X- skiller seg enormt ut i deres egenskaper og i måten de samhandler med miljøet på.
Hvis X nå antas å være H-atomet, kan det for eksempel oppstå en kation eller anion: H+ eller H-, henholdsvis. Kationen H+ Det er hydrogenionet, også kalt proton; og H- er hydridanionet, det "enkleste" av alle kjente anioner.
Artikkelindeks
- 1 Dannelse av et anion
- 1.1 Formelle kostnader og færre lenker
- 1.2 Reduksjoner
- 1.3 Fysikk
- 2 funksjoner
- 3 typer
- 3.1 Monatomisk
- 3.2 Oxoanions
- 3.3 Organisk
- 3.4 Polyatomisk
- 3.5 Molekylær eller kompleks
- 4 Referanser
Dannelse av et anion
Dannelsen av et anion kan lett forklares innenfor teorien; Selv om det eksperimentelt kan være en utfordring, spesielt hvis du vil ha det rent, uten positive ladninger tiltrukket av de negative ladningene..
Formelle kostnader og færre lenker
Et anion vil dannes når det er et overskudd eller gevinst av elektroner i et atom. Nevnte gevinst kan bestemmes ved å benytte seg av de formelle kostnadene i en Lewis-struktur. Ved å bruke den forrige metoden kan du også vite nøyaktig fra hvilket atom eller gruppe av dem den negative ladningen kommer.
Når atomer danner kovalente bindinger, selv om fordelingen av elektroner er rettferdig, kan det være et delvis tap av elektroner. I denne forstand, jo færre bindinger jo flere elektronegative atomer dannes, jo flere frie par elektroner vil de ha og derfor har negative ladninger..
Tenk for eksempel på ammoniakkmolekylet, NH3. NH3 den er nøytral og har derfor ingen elektriske ladninger. Hvis en H ble fjernet, det vil si at en N-H-binding ble brutt, ville anionet NH oppnåsto-. Ved å tegne sin Lewis-struktur og beregne den formelle ladningen av N, kan dette verifiseres.
Etter å ha brutt flere NH-obligasjoner, har vi nå NH-anionetto-; og eliminering av den siste H, anionen N er endelig oppnådd3-, kalt nitridanion. Nitrogen har ikke lenger en måte å skaffe seg flere elektroner på, og dens -3 ladning er det mest negative det kan nå; deres orbitaler gir ikke mer.
Reduksjoner
Et anion kan dannes som et resultat av en reduksjon: det får elektroner ved å oksidere en annen art, som mister dem. Oksygen representerer for eksempel denne typen kjemisk reaksjon veldig bra..
Når oksygen reduseres, oksiderer det til en annen art, og blir til oksidanionet, Oto-; til stede i utallige mineraler og uorganiske forbindelser.
Fysisk
Et atom kan få elektroner hvis det er i gassfasen:
X (g) + e- => X-(g)
Denne måten å danne et anion på innebærer en bred kunnskap om fysiske teknikker, mens gassanioner ikke er enkle å studere, og heller ikke er alle arter lett fordampet eller forstøvet til gassfasen..
Kjennetegn
Generelt vil de typiske egenskapene til et anion bli nevnt nedenfor før de diskuterer deres typer og eksempler:
-Det er større enn det nøytrale atomet som det er avledet fra.
-Det kan være mer eller mindre stabilt, til tross for den økende elektroniske frastøtingen mellom sine egne elektroner.
-Hvis anionet kommer fra et lavt elektronegativt atom, for eksempel karbon, er det veldig reaktivt.
-Etabler sterke dipolmomenter.
-Ytterligere øker interaksjonen med polare løsemidler.
-Den monatomiske anionen er isoelektronisk til edelgassen i sin periode; det vil si at den har samme antall elektroner i valensskallet.
-Det kan polarisere elektronskyen til et nærliggende atom, og frastøte de ytre elektronene.
Typer
Monatomisk
Som navnet antyder, er det et anion som består av et enkelt atom: den negative ladningen er godt plassert. Hver gruppe i det periodiske systemet har karakteristiske negative ladninger; og fordi de er anioner, er de ikke-metallene som ligger i p-blokken. Noen eksempler og navnene deres er nedenfor:
-Cl-, klorid.
-Jeg-, jeg Varer.
-F-, fluor.
-Br-, bromid.
-ELLERto-, oksid.
-Sto-, sulfid.
-Jeg vetto-, selenid.
-Teto-, telluride.
-Poto-, poloniur.
-N3-, nitrid.
-P3-, fosfid.
-Ess3-, arsenid.
-Sb3-, antimoniuro.
-C4-, karbid.
-Ja4-, silisid.
-B3-, boruro.
Oxoanions
Oksoanioner er karakterisert ved å ha en X = O-binding, hvor X kan være et hvilket som helst ikke-metallisk element (unntatt fluor), eller et metall (krom, mangan, ect.). De kan også ha en eller flere X-O enkle lenker.
Noen oksoanioner med deres respektive navn er:
-ClO-, hypokloritt.
-BrO-, hypobromitt.
-IO-, hypojoditt.
-ClOto-, kloritt.
-ClO3-, klorat.
-IO3-, jodat.
-ClO4-, perklorat.
-PO43-, fosfat.
-CO3to-, karbonat.
-CrO4to-, kromat.
-CrtoELLER7to-, dikromat.
-SW4to-, sulfat.
-StoELLER3to-, tiosulfat.
-IKKE3-, nitrat.
-IKKEto-, nitritt.
-BO33-, borat.
-AsO43-, arsenat.
-PO33-, fosfitt.
-MnO4-, permanganat.
Organisk
Organiske molekyler har funksjonelle grupper som kan bli elektrisk ladet. Hvordan? Gjennom dannelse eller brudd av kovalente bindinger, veldig lik eksemplet med NH-molekylet3.
Noen organiske anioner er:
-CH3COO-, acetat.
-HCOO-, Format.
-CtoELLER4to-, oksalat.
-RCOO-, karboksylat.
-CH3CONH-, amidate.
-RO-, alkoksid.
-R3C-, karbanion.
-CH3ELLER-, metoksid.
Polyatomisk
Oksoanioner er også polyatomiske anioner, det vil si at de består av mer enn ett atom. Det samme skjer med organiske anioner. Imidlertid faller polyatomics ikke inn under noen av klassifiseringene ovenfor. Noen av dem er:
-CN-, cyanid (har en trippelbinding, C≡N).
-OCN-, cyanat.
-SCN-, tiocyanat.
-NHto-, Amide.
-Åh-, hydroksyl, hydroksyd eller hydroksyl.
-ELLERto-, superoksid.
-ELLERtoto-, peroksid.
Molekylær eller kompleks
I organiske anioner ble noen negativt ladede funksjonelle grupper nevnt. Disse gruppene kan være en del av et stort molekyl, og dermed kan anionen være en hel robust forbindelse med mange bindinger. Den enkleste av denne typen anioner er det hypotetiske molekylet av Hto-.
Et annet eksempel på disse anionene er polysulfider, Snto-, som består av kjeder med flere SS-obligasjoner. Også negativt ladede metallkoordineringsforbindelser som [CoCl4(NH3)to]- og [CuCl4]to-.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2019). Anion. Gjenopprettet fra: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (21. mars 2019). Common Anions Table and Formulas List. Gjenopprettet fra: thoughtco.com
- CK-12 Foundation. (2016, 29. juni). Aniondannelse. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Francis E. (2002). Anioner. Clackamas Community College. Gjenopprettet fra: dl.clackamas.edu
- American Physical Society. (3. november 2011). Synopsis: The Simplest Molecular Anion. Gjenopprettet fra: physics.aps.org



Ingen har kommentert denne artikkelen ennå.