
Peroksidegenskaper, nomenklatur, bruksområder, eksempler
De peroksider er alle de kjemiske forbindelsene som inneholder peroksogruppen, O-O, enten kovalent bundet til karbonatomer eller andre funksjonelle grupper, eller i ionisk form, slik som peroksydanionen,toto-. Ovenstående er representert grafisk i bildet nedenfor. I den er gruppen O-O uthevet med en blå farge.
Det kan være organiske peroksider som diakylperoksider (R1-O-O-Rtohydroperoksider (R-O-O-H), persyrer (RCO-O-O-H) og perestere (R1CO-O-O-Rto). Vi har også uorganiske peroksider, slik som metalliske peroksider (Mn+ELLERtoto-) og hydrogenperoksyd (H-O-O-H). Sistnevnte er den mest kjente av alle, og mottar navnet hydrogenperoksid.
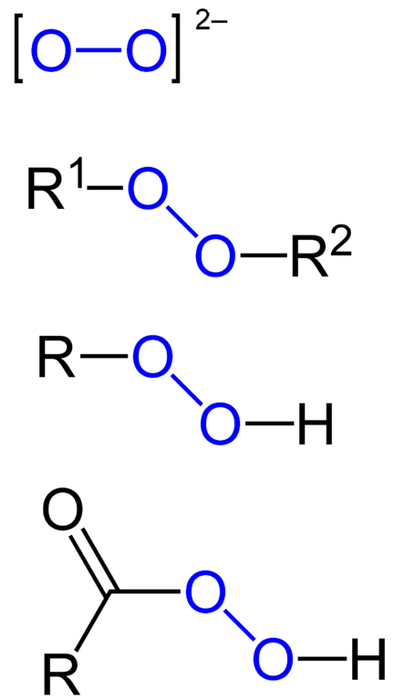
Alle peroksider har det til felles at de er svært reaktive, oksiderende og i noen tilfeller eksplosive stoffer. Med mindre de er syntetisert, betraktes de som uønskede og farlige urenheter for mange industrielle prosesser og for laboratoriesyntese..
Peroksider er generelt gode oksiderende, blekende, bakteriedrepende midler og aktivatorer av polymerisasjoner via dannelsen av frie radikaler. Det er derfor de vanligvis er veldig nyttige reagenser eller tilsetningsstoffer i polymerindustrien, så vel som i næringsmiddelindustrien for å akselerere oksidasjon og eliminere bakterier..
Artikkelindeks
- 1 Egenskaper av peroksider
- 1.1 Struktur
- 1.2 Reaktivitet
- 1.3 Oksiderende virkning
- 1.4 Følsomhet
- 2 Nomenklatur
- 3 Trening
- 4 Bruk av peroksider
- 4.1 Polymeriseringsinitiatorer
- 4.2 Blekemidler og desinfeksjonsmidler
- 4.3 Oksidasjonsmidler
- 4.4 Oksygenkilder
- 5 Eksempler på peroksider
- 6 Referanser
Egenskaper av peroksider
Struktur
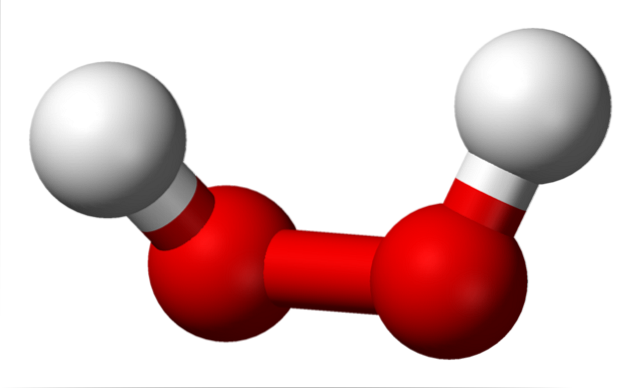
Strukturene til peroksider er sentrert rundt O-O-gruppen. Hvert oksygenatom har en sp-hybridisering3, slik at -O-O- lenker ikke hviler på samme plan. For eksempel, for hydrogenperoksid, H-O-O-H, er vinkelen dannet mellom de to Hs 115,5 °, noe som viser at de fire atomer ikke er i et plan..
Forvrengningene av denne og andre vinkler vil avhenge av identiteten til de andre molekylære fragmentene som er knyttet til O-O-gruppen..
På den annen side kan organiske og uorganiske peroksider (med unntak av metalliske) gjenkjennes med det blotte øye hvis O-O-gruppen er detaljert i sin struktur, som to glass med en "munn". På denne måten blir ethvert peroksid umiddelbart identifisert med et enkelt blikk av strukturen..
Reaktivitet
O-O-bindingen er relativt svak sammenlignet med andre obligasjoner som C-H eller C-O. Det er derfor det har en tendens til å bryte ned eller fragmentere for å produsere svært reaktive oksygenerte radikaler..
Det er på grunn av disse radikalene at peroksider klassifiseres som reaktive og farlige stoffer, da de kan skade vev og ethvert organisk materiale generelt..
Oksiderende handling
Peroksider er kraftige oksidasjonsmidler som søker å skaffe elektroner fra omgivelsene for å transformere til vann, oksygen eller hydroksider. For eksempel er hydrogenperoksid et sterkere oksidasjonsmiddel enn selve kaliumpermanganat..
Denne oksidasjonsvirkningen brukes til å oppdage dem gjennom reaksjonen med jernholdig sulfat og kaliumtiocyanat:
Peroksid + Feto+ + SCN- → Fe (SCN)n(3-n)- (n = 1 til 6).
Komplekset dannet mellom Fe3+ og SNA- den er blodrød i fargen, så det å observere denne fargen tilsvarer en positiv test for tilstedeværelsen av peroksider i prøven.
Følsomhet
Peroksider er stoffer som er følsomme for høye temperaturer og sollys. Derfor bør de lagres på trygge steder og i ugjennomsiktige plastbeholdere, på en slik måte at lys ikke skinner direkte på dem..
Nomenklatur
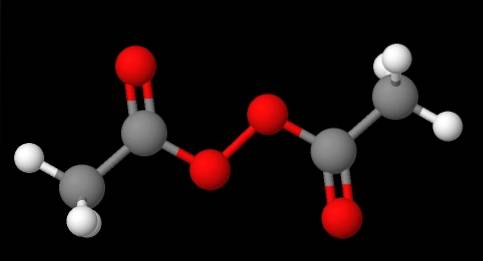
Nomenklaturen for peroksider avhenger av hvilken type de tilhører. Generelt er mange navngitt ved å nevne 'peroksid' etterfulgt av R-substituentene i alfabetisk rekkefølge. For eksempel kan forbindelsen CH3C (O) OOC (O) CH3 (nedre bilde) kalles diacetyl eller acetylperoksid, da den har en acetylgruppe i hver ende.
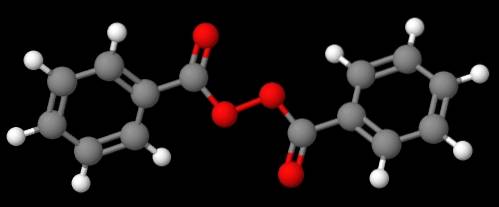
Forbindelse C6H5C (O) OOC (O) C6H5 (nedre bilde), derimot, kalles det dibenzoyl eller benzoylperoxide, av de samme grunnene som er forklart i forrige avsnitt.
I mellomtiden, forbindelse C6H5C (O) OOC (O) CH3 Det kalles acetylbenzoylperoksid. Denne gangen nevnes acetylsubstituenten først ved å begynne med bokstaven 'a'. Et annet eksempel er CH3CHtoOOC6H5, kalt etylfenylperoksyd.
På en lignende måte fortsetter vi med hydroperoksidene. For eksempel CH3OOH kalles metylhydroperoksyd.
Opplæring
Noen peroksider kan dannes direkte ved eksponering av det aktuelle stoffet med oksygen i luften, assistert eller ikke med metalliske katalysatorer. De kan også dannes ved å utsette stoffet for ozon under visse forhold, og utføre ozonolysereaksjonen..
En annen syntetisk vei er å reagere hydrogenperoksyd med et alkylsulfat:
RtoSW4 + HtoELLERto → R-O-O-R + HtoSW4
For å syntetisere eller danne dialkylperoksider eller til og med sykliske peroksider.
I mellomtiden er flere av metodene for å danne metallperoksider basert på å oksygenere sine respektive metalloksider, slik at de "oksygenerer" og går fra å være MO (Mn+ELLERto-) kjærlighetto (Mn+ELLERtoto-).
Bruk av peroksider
Polymeriseringsinitiatorer
Peroksider, spesielt organiske peroksider, tilsettes reaksjonsmedier for syntese av uendelig mange plastmaterialer som polystyren, silikon, epoksy og akrylharpiks, polyvinylklorid, glassfiber, blant andre.
Dette er fordi de gjennomgår termisk nedbrytning for å bli oksygenerte frie radikaler, som igjen utløser og katalyserer polymerisasjoner. Derfor er de ønskelige i polymerindustrien..
Noen av peroksidene som brukes som initiatorer er metyletylketon (MEK) peroksid og acetonperoksid.
Blekemidler og desinfeksjonsmidler
Peroksider er blekemidler som brukes til bleking av papirmasse og mel. På samme måte er de desinfiserende midler, helt effektive, selv om de er aggressive når det gjelder utryddelse av bakterier. Det klassiske eksemplet tilsvarer hydrogenperoksid, brukt i fortynnede oppløsninger (3%) for å desinfisere sår..
Oksidasjonsmidler
Peroksider er også oksidasjonsmidler, så de finner mange bruksområder i de organiske syntesene av sterkt oksygenerte stoffer..
Oksygenkilder
Selv om det ikke er blant de viktigste bruksområdene, kan peroksider også tjene som oksygenkilder i noen av dets nedbrytninger. Dette er igjen tilfellet med hydrogenperoksid.
Eksempler på peroksider
Til slutt vil noen eksempler på peroksider, enten organiske eller uorganiske, med formler og respektive navn bli oppført:
-HtoELLERto: hydrogenperoksid eller hydrogenperoksid
-NatoELLERto: natriumperoksid
-Stråleto: bariumperoksid
-C6H5C (CH3)toOOH: kumenhydroperoksid
-(NH4)toStoELLER8: Ammoniumpersulfat
- HO3SOOSO3H: peroksydsvovelsyre
-(CH3)3COOC (CH3)3: ditert-butylperoksid
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Organisk peroksid. Gjenopprettet fra: en.wikipedia.org
- Elsevier B.V. (2020). Peroksid. ScienceDirect. Gjenopprettet fra: sciencedirect.com
- Avansert kjemiutvikling. (s.f.). Alkoholer, fenoler og deres derivater:
- Peroksider Regel C-218. Gjenopprettet fra: acdlabs.com
- Vol'nov I.I., Petrocelli A.W. (1966) Klassifisering og nomenklatur for uorganiske peroksidforbindelser. I: Petrocelli A.W. (red) Peroksider, superoksider og ozonider av alkaliske og jordalkalimetaller. Springer, Boston, MA.



Ingen har kommentert denne artikkelen ennå.