
Tørr cellestruktur og funksjon
EN Tørrcelle det er et batteri hvis elektrolytiske medium består av en pasta og ikke en løsning. Nevnte pasta har imidlertid et visst fuktighetsnivå, og av disse grunner er den ikke strengt tørr..
Den lille mengden vann er tilstrekkelig for ionene å bevege seg og følgelig strømmen av elektroner inne i cellen..

Den enorme fordelen i forhold til de første våte batteriene er at siden det er en elektrolytisk pasta, kan innholdet ikke spilles; som var tilfelle med våte batterier, som var farligere og delikatere enn deres tørre kolleger. Gitt umuligheten av søl, finner den tørre cellen bruk i mange bærbare og mobile enheter.
På bildet over er det et tørt sink-karbonbatteri. Mer nøyaktig, det er en moderne versjon av Georges Leclanché-stakken. Av alt er det den vanligste og kanskje den enkleste.
Disse enhetene representerer en energisk bekvemmelighet på grunn av det faktum at de har kjemisk energi i lommen som kan transformeres til elektrisitet; og på denne måten, ikke avhengig av strømuttak eller energien som leveres av store kraftverk og deres enorme nettverk av tårn og kabler.
Artikkelindeks
- 1 Struktur av den tørre cellen
- 1.1 Elektroder
- 1.2 Terminaler
- 1.3 Sand og voks
- 2 Drift
- 2.1 Oksidasjon av sinkelektroden
- 2.2 Reduksjon av ammoniumklorid
- 2.3 Last ned
- 3 Referanser
Tørr cellestruktur
Hva er strukturen til en tørr celle? På bildet kan du se dekselet, som ikke er noe mer enn en polymer film, stål og de to terminalene hvis isolerende skiver stikker ut fra fronten.
Dette er imidlertid bare hans ytre utseende; de viktigste delene ligger inne, som garanterer at den fungerer korrekt.
Hver tørr celle vil ha sine egne egenskaper, men bare sink-karboncellen vil bli vurdert, hvorav en generell struktur for alle andre batterier kan skisseres..
Batteri forstås som foreningen av to eller flere batterier, og sistnevnte er voltaiske celler, som vil bli forklart i en fremtidig seksjon..
Elektroder
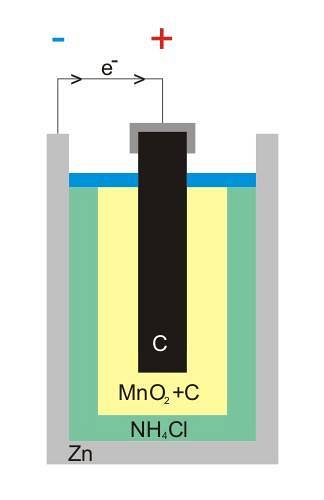
Det øvre bildet viser den interne strukturen til et sink-karbonbatteri. Uansett hva den voltaiske cellen er, bør det alltid (vanligvis) være to elektroder: en som elektronene avgir fra, og en annen som mottar dem..
Elektroder er elektrisk ledende materialer, og for at det skal være strøm, må begge ha forskjellige elektronegativiteter.
For eksempel er sink, en hvit tinn som lukker batteriet, der elektronene forlater den elektriske kretsen (enheten) der den er koblet til.
På den annen side er den grafittiske karbonelektroden i hele mediet; også nedsenket i en pasta sammensatt av NH4Cl, ZnClto og MnOto.
Denne elektroden er den som mottar elektronene, og merk at den har symbolet '+', som betyr at den er den positive terminalen på batteriet.
Terminaler
Som vist over grafittstangen på bildet, er det den positive elektriske terminalen; og under kan det indre sinket som elektroner strømmer fra, den negative terminalen.
Det er grunnen til at batteriene har '+' eller '-' markeringer for å indikere riktig måte å koble dem til enheten og dermed la den slå på..
Sand og voks
Selv om det ikke er vist, er pastaen beskyttet av en buffersand og en voksforsegling som forhindrer den fra å søle eller komme i kontakt med stålet under mindre mekaniske støt eller uro..
Fungerer
Hvordan fungerer en tørr celle? Til å begynne med er det en voltaisk celle, det vil si at den genererer elektrisitet fra kjemiske reaksjoner. Derfor forekommer redoksreaksjoner i celler, der arten får eller mister elektroner..
Elektrodene tjener som en overflate som letter og tillater utvikling av disse reaksjonene. Avhengig av deres ladninger kan oksidasjon eller reduksjon av arten forekomme.
For å bedre forstå dette, vil bare de kjemiske aspektene av sink-karbonbatteriet bli forklart..
Sinkelektrodeoksidasjon
Så snart den elektroniske enheten er slått på, frigjør batteriet elektroner ved å oksidere sinkelektroden. Dette kan representeres av følgende kjemiske ligning:
Zn => Znto+ + 2e--
Hvis det er mye Znto+ rundt metallet, vil en positiv ladningspolarisering forekomme, så det vil ikke være ytterligere oksidasjon. Derfor er Znto+ må diffundere gjennom pastaen mot katoden, der elektronene kommer inn igjen.
Når elektronene har aktivert gjenstanden, går de tilbake til den andre elektroden: grafitten, for å finne noen kjemiske arter som "venter" på den..
Ammoniumkloridreduksjon
Som tidligere nevnt er det NH i pasta4Cl og MnOto, stoffer som gjør pH-verdien sur. Så snart elektronene kommer inn, vil følgende reaksjoner skje:
2NH4+ + 2e- => 2NH3 + Hto
De to produktene, ammoniakk og molekylært hydrogen, NH3 og Hto, de er gasser, og derfor kan de "hovne opp" batteriet hvis de ikke gjennomgår andre transformasjoner; slik som følgende to:
Znto+ + 4NH3 => [Zn (NH3)4]to+
Hto + 2MnOto => 2MnO (OH)
Merk at ammonium ble redusert (oppnådde elektroner) for å bli NH3. Disse gassene ble deretter nøytralisert av de andre komponentene i pastaen..
Komplekset [Zn (NH3)4]to+ muliggjør diffusjon av Zn-ionerto+ mot katoden og dermed forhindre at batteriet "går i stå".
Den eksterne kretsen til gjenstanden fungerer som en bro for elektronene; ellers ville det aldri være en direkte forbindelse mellom sinkboksen og grafittelektroden. På bildet av strukturen vil denne kretsen representere den svarte kabelen.
nedlasting
Tørrceller finnes i mange varianter, størrelser og arbeidsspenninger. Noen av dem er ikke oppladbare (primære voltaiske celler), mens andre er (sekundære voltaiske celler).
Sink-karbon batteriet har en arbeidsspenning på 1,5V. Formene deres endres basert på elektrodene og sammensetningen av elektrolyttene..
Det vil komme et punkt der all elektrolytten har reagert, og uansett hvor mye sink oksideres, vil det ikke være noen arter som mottar elektronene og fremmer frigjøring..
I tillegg kan det være tilfelle hvor de dannede gassene ikke lenger nøytraliseres og forblir utøvende trykk inne i batteriene..
Sink-karbonbatterier og andre batterier som ikke er oppladbare, må resirkuleres; siden komponentene, spesielt nikkel-kadmiumkomponenter, er skadelige for miljøet av forurensende jord og vann.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- "Dry-Cell" -batteriet. Gjenopprettet fra: makahiki.kcc.hawaii.edu
- Hoffman S. (10. desember 2014). Hva er et tørt cellebatteri? Gjenopprettet fra: upsbatterycenter.com
- Ugress, Geoffrey. (24. april 2017). Hvordan fungerer tørre cellebatterier? Vitenskapelig. Gjenopprettet fra: sciencing.com
- Woodford, Chris. (2016) Batterier. Gjenopprettet fra: explainthatstuff.com.


Ingen har kommentert denne artikkelen ennå.