
Natriumklorid (NaCl) struktur, egenskaper, bruksområder
De natriumklorid, Også kalt vanlig salt eller bordsalt, det er et binært uorganisk salt av alkalimetallnatrium og halogenklor. Det er den største komponenten av spiselig salt, og mineralformen er kjent som halitt. Dens molekylformel er NaCl, og den beskriver det støkiometriske forholdet mellom ionene (Na+ Cl-) og ikke det fra et diskret molekyl (Na-Cl)
Natriumklorid er et hvitt, krystallinsk fast stoff som dannes ved kombinasjonen av natrium, et sølvhvitt metall, som reagerer voldsomt med vann, og elementet klor, en giftig, etsende og lysegrønn gass..

En del av NaCl-krystaller er vist på det øvre bildet. Hvordan er det mulig at to like farlige elementer som Na og Clto, et spiselig salt kan dannes? For det første er den kjemiske ligningen for dannelsen:
2Na (s) + Clto(g) => 2NaCl (s)
Svaret ligger i naturen til bindingen i NaCl. Å være ionisk, egenskapene til Na+ og Cl- er diagonalt forskjellige fra sine nøytrale atomer.
Natrium er et viktig element, men i sin ioniske form. Deretter en+ er den viktigste ekstracellulære kationen med en konsentrasjon på ca. 140 mEq / l, og sammen med ledsagende anioner, Cl- og HCO3- (bikarbonat), er hovedsakelig ansvarlige for verdien av osmolaritet og ekstracellulært volum.
Videre er Na+ det er ansvarlig for generering og ledning av nerveimpulsen i neuronale aksoner, samt for å initiere muskelsammentrekning.
NaCl har blitt brukt siden eldgamle tider for å smake mat og bevare kjøtt på grunn av dets evne til å drepe bakterier og forhindre ødeleggelse.
Det er også nødvendig for produksjon av natriumhydroksid (NaOH) og molekylært klor (Cltoreagerer NaCl med vann under hydrolyse:
2HtoO (l) + 2 NaCl (s) => 2NaOH (aq) + Clto(g) + Hto(g)
I katoden (-) akkumuleres Hto (g) og NaOH. I mellomtiden akkumuleres Cl i anoden (+)to (g). Natriumhydroksid brukes til fremstilling av såper og klor til fremstilling av PVC-plast.
Artikkelindeks
- 1 Struktur av natriumklorid
- 1.1 Enhetscelle
- 2 eiendommer
- 2.1 Molekylformel
- 2.2 Molekylvekt
- 2.3 Fysisk beskrivelse
- 2.4 Farge
- 2.5 Smak
- 2.6 Kokepunkt
- 2.7 Smeltepunkt
- 2.8 Løselighet i vann
- 2.9 Løselighet i organiske løsningsmidler
- 2.10 Tetthet
- 2.11 Damptrykk
- 2.12 Stabilitet
- 2.13 Nedbrytning
- 2.14 Viskositet
- 2.15 Korrosjon
- 2,16 pH
- 3 bruksområder
- 3.1 I mat
- 3.2 Industrielle bruksområder
- 3.3 Hjemme
- 3.4 Andre bruksområder
- 3.5 Terapeutiske bruksområder
- 4 Toksisitet
- 4.1 Svelging
- 4.2 Irritasjon og fysisk kontakt
- 5 Referanser
Struktur av natriumklorid
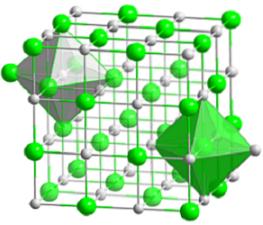
Det øvre bildet representerer den kompakte kubiske strukturen til natriumklorid. De voluminøse grønne kulene tilsvarer Cl-anionene-, mens de hvite, til Na-kationene+. Legg merke til hvordan NaCl-krystallet består av et nettverk av ioner arrangert av deres elektrostatiske interaksjoner i forholdet 1: 1..
Selv om søyler er vist på bildet, er ikke bindingene kovalente, men ioniske. Bruk av stenger er nyttig når du viser koordineringsgeometrien rundt et ion. For eksempel når det gjelder NaCl hver Na+ er omgitt av seks Cl- (hvit oktaeder), og hver Cl- av seks Na+ (grønn oktaeder).
Derfor har den en koordinering (6,6) hvis tall indikerer hvor mange naboer som omgir hvert ion. Tallet til høyre angir naboene til Na+, mens den til venstre, de til Cl-.
Andre representasjoner utelater bruk av søyler for å markere de oktaedriske hullene i strukturen, som er et resultat av det mellomliggende rommet mellom seks Cl-anioner.- (eller Na-kationer+) pakket. Dette arrangementet observeres i andre mono (MX) eller polyatomiske uorganiske salter, og kalles juvelesaltet.
Enhetscelle
Enhetscellen av bergsalt er kubisk, men hvilke kuber representerer den nøyaktig i bildet ovenfor? Oktahederne gir svaret. Begge dekker en total celle som består av fire små kuber.
Disse terningene har deler av ionene ved sine hjørner, kanter og ansikter. Ser nøye på, en Na ion+ den ligger i sentrum og tolv av dem på kantene. Et ion på en kant kan deles med fire kuber. Så det er 4 Na-ioner+ (12 × 1/4 + 1 = 4).
For klioner-, åtte er plassert i toppunktene og seks i kantene. Da ionene plassert i toppunktene deler plass med åtte andre kuber, og i kantene med seks, har vi 4 Cl-ioner- (8 × 1/8 + 6 × 1/2 = 4).
Ovennevnte resultat tolkes som følger: i enhetscellen til NaCl er det fire Na-kationer+ og fire Cl-anioner-; andel som stemmer overens med den kjemiske formelen (a Na+ for hver Cl-).
Eiendommer
Molekylær formel
NaCl.
Molekylær vekt
58,44 g / mol.
Fysisk beskrivelse
Et krystallinsk fast stoff.
Farge
Gjennomsiktige fargeløse krystaller eller hvitt krystallinsk pulver.
Smak
Salt.
Kokepunkt
2,575ºF til 760 mmHg.
1465 ºC.
Smeltepunkt
1.474 ºF (800.7 ºC).
Både kokepunktet og smeltepunktet gjenspeiler varmen som er nødvendig for å overvinne den krystallinske gitterenergien. Derfor bekrefter disse målingene den ioniske karakteren til NaCl..
Vannløselighet
Større enn eller lik 100 mg / ml ved 68ºF.
36,0 g / 100 ml ved 25 ° C.
Det er faktisk et hygroskopisk salt som holder på fuktigheten fra omgivelsene.
Løselighet i organiske løsningsmidler
0,065 g / 100 ml etanol ved 25 ° C; 10 g / 100 g glyserol ved 25 ° C; 2,15 g / 100 ml flytende ammoniakk ved 40 ° C; 1,4 g / 100 ml metanol ved 25 ° C; 7,15 g / 100 etylenglykol ved 25 ° C og 5,21 g / 100 g maursyre ved 25 ° C.
Tetthet
2,165 g / cm3 ved 77 ºC.
Damptrykk
1 mmHg ved 1589ºF.
Stabilitet
Stabil under anbefalte lagringsforhold.
Nedbrytning
Ved oppvarming til høye temperaturer spaltes den og avgir saltsyre og dinatriumoksyddamp..
Viskositet
Viskositet av mettede løsninger 1,93 mPa-s.
Korrosjon
Det er etsende for mange metaller.
pH
6,7 til 7,3 i vandig oppløsning.
applikasjoner
I mat
-Natriumklorid har blitt brukt siden antikken for å forbedre smaken på maten og bevare den. Salting av kjøtt er en måte å bevare det mot bakteriell handling, da det forsinker nedbrytning av proteiner.
-På den annen side øker salt osmolariteten rundt kjøttet, noe som forårsaker absorpsjon av bakterienes vann ved osmose, og forårsaker eliminering.
Industriell bruk
Mat industri
-I næringsmiddelindustrien brukes salt som smaksforsterker, gjæringskontrolltilsetningsstoff, teksturkontrollmiddel og fargeutvikler. For eksempel tilsettes salt for å få frem fargen i bacon, skinke og andre kjøttprodukter..
-Salt fungerer som et bindemiddel for å lage pølser. Bidrar til dannelsen av en bindemiddelgel bestående av kjøtt, fett og fuktighet.
-Ved melbearbeiding for brødfremstilling tilsettes salt under steking for å kontrollere hastigheten på suging av brøddeig. Det brukes også til å styrke gluten og som smaksforsterker, samt fylling av bakevarer.
-Den brukes til fremstilling av frokostblandinger, blandede eller tilberedte mel, pommes frites, hund- og kattemat osv..
Syntese av kjemikalier
-Natriumklorid brukes som råvare i produksjonen av natriumhydroksid og klor, som igjen er nyttige i mange kjemiske industrier.
-Salt brukes i behandlingen av forskjellige metaller, for eksempel aluminium, kobber, stål og vanadium. Det brukes også til å lage natriumklorat, som senere brukes i syntesen av klordioksid, et oksygenbasert blekemiddel. Klordioksid er mindre skadelig for miljøet enn andre blekemidler.
I lærindustrien
-Saltet brukes til å hemme bakterievirkningen i huden, samt for å hjelpe til med rehydrering.
I tekstilindustrien
-Salt brukes som mordant i farging av tekstiler. Den brukes som saltvannsskylling for å fjerne organiske forurensninger og for å skape en positiv ladning på overflaten av tekstiler som muliggjør binding av negativt ladede fargestoffer..
I oljeindustrien
-Ved leting etter olje og gass er salt en viktig komponent i brønnborevæsker. Den brukes til å flokkulere og øke tettheten av borevæsker, noe som gjør det mulig å overvinne det høye gasstrykket i brønnene som skal nås. I tillegg opprettholder salt metningen av borevæsken.
-Salt hjelper til med å komprimere jorden som veiene er bygget på. Reduserer underjordisk forskyvning forårsaket av fuktighetsendringer og biltrafikk.
I hjemmet
Salt har blitt brukt ved å gni inn rengjøringsflater, gryter og panner. Også i forebygging av mugg og som flekkfjerner. Det brukes også i mange merker av sjampo og tannkrem..
Andre bruksområder
På veiene
-I påvente av snøfall er veiene dekket med saltlake, noe som forhindrer at is binder seg til veidekket. For tining brukes en blanding av saltlake og salt, og noen ganger tilsettes andre kjemiske komponenter som magnesium eller kalsiumklorid. Bruk av salt og saltlake er ikke effektiv ved temperaturer under -10 ºC.
Tilsetning av salt produserer en reduksjon i kryoskopisk punkt, en kolligativ egenskap for løsningene, og hindrer dermed dannelsen av is på en bestemt måte..
-På grunn av sin hygroskopiske tilstand brukes salt som et billig tørkemiddel.
I harpiks som brukes til å myke opp vann
Hardt vann inneholder kalsium- og magnesiumioner som hindrer virkningen av såpe og forårsaker avleiringer av alkaliske materialer på diverse utstyr og rør. I vannmykning brukes ionebytterharpikser. Salt brukes til fremstilling og regenerering av harpiks.
I brannslukkere
Natriumklorid brukes i brannslukningsapparater for å bekjempe branner der det er brennbare metaller, som magnesium-, kalium-, natrium- og NK-legeringer..
Salt fungerer som en kjøleribbe og danner også en skorpe som begrenser oksygentilgang til bålet..
I brillene
Natriumkloridkrystaller brukes i optiske komponenter som vinduer og prismer, spesielt for infrarødt lys. Siden saltet er veldig hygroskopisk, produseres det imidlertid en slags frost som dekker linsene. Av denne grunn har natriumkloridlinser blitt erstattet av sink-selenid (ZnSe) -linser..
Terapeutiske bruksområder
Gjør opp for mangelen på salt i kroppen
-Når det er en kroppslig utarmning av Na+, må skiftes ut for å opprettholde ekstracellulær osmolaritet, nerveledning og muskelsammentrekning.
-NaCl brukes til behandling og forebygging av mangel på natrium og klor, som skyldes overdreven svetting under eksponering for høye temperaturer. Det brukes også i en overdreven diurese eller en overdreven begrensning av saltinntaket.
-Parenteral levering av en 045% NaCl-løsning brukes til behandling av hyperosmolar diabetes. Den oppfyller en rehydratiserende funksjon og tjener til å vurdere status for nyrefunksjonen.
-Injeksjoner av hypertoniske løsninger, med en NaCl-konsentrasjon større enn 0,9% vekt / volum,
-De brukes når det er en kraftig Na-utarmning+, å være en restaurering av det essensielle ionet. Denne hyponatremia kan være en konsekvens av en behandling med frie elektrolytter eller med en konsentrasjon av Na+.
Hyponatremi kan også være forårsaket av overdreven vanninntak, ikke kontrollert av utilstrekkelig nyrefunksjon..
I ukonvensjonelle behandlinger og bruksområder
-NaCl-inhalasjonsløsninger brukes til å fortynne legemidlene som brukes under forstøvningsprosessen. Det brukes også til trakealskylling og vanning. 0,9% saltløsning brukt i nesespray.
-20% NaCl-løsninger brukes til intra-fostervanns transabdominal installasjon, og induserer derved en sen abort i løpet av andre trimester av svangerskapet..
-Natriumklorid kan brukes som et lokalt antiseptisk middel. Takket være sin osmotiske kapasitet er den i stand til å dehydrere et bredt spekter av virus og bakterier i en ikke-ansporet tilstand; Derfor brukes den som et smertefullt antiseptisk middel for å desinfisere sår.
Toksisitet
Svelging
Det virker bare skadelig på helsen hvis inntaket er høyt og i lang tid. Under disse omstendighetene vil hypernatremi forekomme med den påfølgende økningen i ekstracellulært volum som vil føre til arteriell hypertensjon..
Irritasjon og fysisk kontakt
Det har bare en giftig effekt hvis innåndingen er veldig høy. Overdreven kontakt med huden kan føre til at den blir tørr. Til slutt forårsaker det en øyeblikkelig irritasjon ved kontakt med øynene.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave., S. 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Learning, s 482-483.
- Natriumklorid. (2018). Sodium Chloride: Fordeler, bruksområder, egenskaper, risiko. Hentet fra: natriumklorid.org
- PubChem. (2018). Natriumklorid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Natriumklorid. Hentet fra: en.wikipedia.org
- Amerikanske elementer. (2018). Natriumklorid. Hentet fra: americanelements.com



Ingen har kommentert denne artikkelen ennå.