
Potentiometer (pH-meter) Hva det er for og hvordan det fungerer

EN potensiometer er enheten som brukes til å måle potensialforskjellen mellom en arbeids- og en referanseelektrode, når begge er nedsenket i en løsning som det er ønskelig å bestemme surheten eller basiteten til, og uttrykker dette som.
På denne måten refererer potensiometri til den analytiske metoden som brukes til å bestemme konsentrasjonen av H-ioner.+ i et stoff som er i løsning ved å bruke et potensiometer og de to nevnte elektrodene.

Når det gjelder referanseelektroden, har den et kjent, konstant og stabilt potensial i motsetning til arbeidselektroden. Potensialet som utvikler seg i denne siste elektroden varierer i forhold til konsentrasjonen av H-ioner+ som er i løsningen.
Dette potensialet er også sterkt påvirket av temperaturen som målingen utføres under..
Artikkelindeks
- 1 Hva er det for?
- 2 Hvordan fungerer det??
- 2.1 Elektroder
- 2.2 Kalibrere et potensiometer
- 3 Referanser
Hva er den til?
Det er et stort antall prosesser som utføres i det industrielle feltet - som legemiddelproduksjon, matforedling og vannrensing - som er svært følsomme for variasjoner i pH-nivåer. Av denne grunn er dens korrekte måling så viktig.
Som tidligere nevnt er pH en parameter som brukes til å måle surheten eller alkaliniteten til en løsning som er i den vandige fasen ved å analysere konsentrasjonen av H-ioner.+ i løsning. Deretter beregnes pH-verdien av følgende ligning:
pH = -log [H+]
Så potensiometeret brukes til å måle pH i et stoff i løsning..
Når potensiometeret er koblet til de to elektrodene som er nedsenket i løsningen som skal analyseres, oppdager det potensialforskjellen mellom arbeidselektroden og referanseelektroden, forsterker dette signalet og konverterer det til en pH-verdi ved hjelp av ligningen beskrevet ovenfor..
Hvordan virker det?
Driften av et potensiometer er basert på mekanismen til en elektrokjemisk celle, hvor H-ioner er involvert+ i den kjemiske reaksjonen til cellen for å bestemme konsentrasjonen av disse ionene i løsningen og på denne måten oppnå pH av den samme.
Når det er ønskelig å måle pH i en løsning ved potensiometri, brukes et potensiometer og en elektrode; den første er enheten som bestemmer pH, mens den andre er basert på kombinasjonen av en referanseelektrode og en måleelektrode som er følsom for analytter.
I denne forstand dannes en krets der den elektriske strømmen strømmer mellom elektrodene og løsningen, der de utfører funksjonen til et batteri når de er nedsenket i den nevnte løsningen..
På denne måten er potensiometeret designet for å generere en spenning lik null (i enheter av millivolt) når den har en pH lik sju; altså nøytral.
På samme måte, når en økning i potensielle verdier blir registrert (med positive tall), betyr det at det er lavere pH-verdier, og når en nedgang observeres - det vil si en vekst mot negative tall - snakker vi om høyere verdier..
Elektroder
Måleelektroden (eller arbeids) består av et apparat der reaksjonen som studeres (oksidasjon eller reduksjon) finner sted.
Selv om det er mange typer, er det vanligvis glass, som består av en veldig tynn glassmembran som har permeabilitet for H-ioner.+ av miljøet det er i.
Ved å plassere dette i en løsning som har en pH som er forskjellig fra løsningen som er tilstede i cellen, genereres en potensiell forskjell mellom de to sidene av membranen, og denne forskjellen kan registreres ved hjelp av en referanseelektrode..
På den annen side er referanseelektroden en innretning som har egenskaper med stabilt potensial og med en kjent verdi, som vanligvis brukes som anode i den elektrokjemiske cellen..
Et eksempel på denne typen elektroder er en som består av en sølvtråd, som er belagt med sølvklorid og nedsenket i en fortynnet saltsyreoppløsning, eller referanseelektroden mettet med kalomel, som den vist i figuren nedenfor.
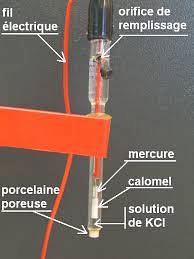
Så potensiometeret bestemmer potensialforskjellen som genereres mellom elektrodene, selv om bare potensialet til arbeidselektroden er avhengig av konsentrasjonen av den ioniske arten..
Kalibrere et potensiometer
Kalibreringen av et potensiometer må utføres gjennom kjente bufferløsninger (også kalt buffere eller bufferløsninger), som består av systemer med praktisk talt uforanderlig pH som inneholder en svak substans og dens konjugerte arter..
Hver buffer har en spesifikk pH, som kan være sur (pH<7), básico (pH>7) eller nøytral (pH = 7), og kan kjøpes kommersielt allerede standardisert eller tilberedes i laboratoriet med sertifiserte reagenser og ved bruk av etablerte og validerte prosedyrer..
Ettersom potensiometre måler pH-verdien innenfor et område som anses bredt, må det være kjent om analytten har en pH større eller mindre enn syv for å fortsette med riktig kalibrering..
Derfor, for prøver hvis pH forventes å være basisk, bør den kalibreres med en bufferløsning med en pH lik sju og en annen med høyere pH (vanligvis brukes en av pH ti)..
På den annen side, for prøver med en forventet sur pH, kalibreres den med en bufferløsning med en pH lik sju og en annen med en lavere pH (vanligvis brukes en pH fire)..
Til slutt må omkalibreringen av dette måleinstrumentet utføres før og etter hver bruk, og resultatene registreres, inkludert dato og klokkeslett de ble utført, og egenskapene til bufferløsningene som ble brukt til å kontrollere det..
Referanser
- Wikipedia. (s.f.). pH-meter. Hentet fra es.wikipedia.org
- Chang, R. (2007). Kjemi, niende utgave. (McGraw-Hill).
- Westcott, C. (2012). Ph-målinger. Hentet fra books.google.co.ve
- Nielsen, C. (1996). Administrere det analytiske laboratoriet: Vanlig og enkel. Hentet fra books.google.co.ve
- Kenkel, J. (2010). Analytisk kjemi for teknikere, tredje utgave. Hentet fra books.google.co.ve
- Cable, M. (2005). Kalibrering: En teknikerveiledning. Hentet fra books.google.co.ve



Ingen har kommentert denne artikkelen ennå.