
Colligative egenskaper (med formler)
De kolligativ eiendom er en hvilken som helst egenskap til et stoff som avhenger av, eller varierer i henhold til, antall partikler som er tilstede i det (i form av molekyler eller atomer), uten å avhenge av naturen til disse partiklene.
Disse kan med andre ord også forklares som egenskaper til løsninger som avhenger av forholdet mellom antall oppløste partikler og antall løsemiddelpartikler. Dette konseptet ble introdusert i 1891 av den tyske kjemikeren Wilhelm Ostwald, som klassifiserte løsemiddelegenskapene i tre kategorier.

Disse kategoriene kunngjorde at kolligasjonsegenskaper utelukkende var avhengig av konsentrasjonen og temperaturen av det oppløste stoffet, og ikke av partiklene..
Videre avhenger additivegenskaper som masse av sammensetningen av det oppløste stoffet, og konstitusjonelle egenskaper avhenger mer av den oppløste molekylens struktur..
Artikkelindeks
- 1 Colligative egenskaper
- 1.1 Reduksjon i damptrykk
- 1.2 Heving av koketemperaturen
- 1.3 Senke frysetemperaturen
- 1.4 Osmotisk trykk
- 2 Referanser
Colligative egenskaper
De kolligative egenskapene studeres hovedsakelig for fortynnede løsninger (på grunn av deres nesten ideelle oppførsel), og er som følger:
Reduksjon i damptrykk
Det kan sies at damptrykket til en væske er likevektstrykket til dampmolekylene som væsken er i kontakt med.
På samme måte er forholdet mellom disse trykkene forklart med Raoults lov, som uttrykker at partielt trykk til en komponent er lik produktet av molfraksjonen av komponenten av damptrykket til komponenten i sin rene tilstand:
PTIL = XTIL . PºTIL
I dette uttrykket:
PTIL = Delvis damptrykk av komponent A i blandingen.
XTIL = Molfraksjon av komponent A.
PºTIL= Damptrykk av ren komponent A.
I tilfelle reduksjon i damptrykket til et løsningsmiddel, skjer dette når en ikke-flyktig løsemiddel tilsettes den for å danne en løsning. Som kjent og per definisjon har ikke et ikke-flyktig stoff en tendens til å fordampe.
Av denne grunn, jo mer av dette løsningsmidlet tilsettes det flyktige løsningsmidlet, desto lavere vil damptrykket være og desto mindre løsemiddel kan unnslippe for å bli en gassformig tilstand..
Så når løsningsmidlet fordamper naturlig eller med makt, vil en mengde løsemiddel til slutt forbli uten å fordampe sammen med den ikke-flyktige løsemidlet..
Dette fenomenet kan forklares bedre med begrepet entropi: når molekylene gjør en overgang fra væskefase til gassfase, øker entropien til systemet..
Dette betyr at entropien til denne gassfasen alltid vil være større enn den for flytende tilstand, fordi gassmolekylene opptar et større volum..
Deretter, hvis entropien til den flytende tilstanden øker ved fortynning, selv om den er knyttet til en løsemiddel, reduseres forskjellen mellom de to systemene. Av denne grunn reduserer reduksjonen i entropi også damptrykket..
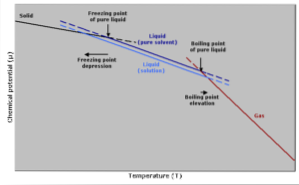
Kokende temperaturøkning
Kokepunktet er den temperaturen der det er likevekt mellom væske- og gassfasene. På dette punktet tilsvarer antall gassmolekyler som blir flytende (kondensering) antall flytende molekyler som fordamper til gass..
Tilsetningen av et løsemiddel får konsentrasjonen av flytende molekyler til å fortynne, noe som får fordampningshastigheten til å avta. Dette genererer en endring i kokepunktet for å kompensere for endringen i løsemiddelkonsentrasjonen..
Med andre enklere ord er koketemperaturen til en løsning høyere enn løsemidlet i ren tilstand. Dette uttrykkes av et matematisk uttrykk vist nedenfor:
ATb = i. Kb . m
I dette uttrykket:
ATb = Tb (løsning) - Tb (løsemiddel) = Variasjon av koketemperatur.
jeg = van't Hoff-faktor.
Kb = Kokekonstant av løsningsmidlet (0,512 ºC / molal for vann).
m = molalitet (mol / kg).
Frysende temperaturreduksjon
Frysetemperaturen til et rent løsningsmiddel vil reduseres når en mengde løsemiddel tilsettes, siden det påvirkes av det samme fenomenet som damptrykket synker..
Dette skjer fordi ved å redusere damptrykket til løsningsmidlet ved å fortynne et oppløst stoff, vil en lavere temperatur være nødvendig for å få det til å fryse..
Naturen til fryseprosessen kan også tas i betraktning for å forklare dette fenomenet: for at en væske skal fryse, må den nå en ordnet tilstand der den ender med å danne krystaller..
Hvis det er urenheter i væsken i form av oppløste stoffer, vil væsken være mindre ordnet. Av denne grunn vil løsningen ha større vanskeligheter med å fryse enn et løsningsmiddel uten urenheter..
Denne reduksjonen uttrykkes som:
ATF = -i. KF . m
I uttrykket ovenfor:
ATF = TF (løsning) - TF (løsemiddel) = Variasjon i frysetemperatur.
jeg = van't Hoff-faktor.
KF = Frysningskonstant for løsningsmidlet (1,86 ºC kg / mol for vann).
m = molalitet (mol / kg).
Osmotisk trykk
Prosessen kjent som osmose er tendensen til et løsningsmiddel å passere gjennom en semipermeabel membran fra en løsning til en annen (eller fra et rent løsningsmiddel til en løsning).
Denne membranen representerer en barriere som noen stoffer kan passere gjennom, og andre ikke, som i tilfelle av semipermeable membraner i celleveggene til dyre- og planteceller..
Osmotisk trykk defineres deretter som minimumstrykket som må påføres en løsning for å stoppe passeringen av det rene løsningsmidlet gjennom en semipermeabel membran..
Det er også kjent som mål på tendensen til en løsning å motta det rene løsningsmidlet på grunn av effekten av osmose. Denne egenskapen er kolligativ siden den avhenger av konsentrasjonen av løsemiddel i løsningen, som uttrykkes som et matematisk uttrykk:
Π. V = n. R. T, eller også π = M. R. T
I disse uttrykkene:
n = Antall mol partikler i løsningen.
R = Universal gasskonstant (8.314472 J. K-1 . muldvarp-1).
T = Temperatur i Kelvin.
M = Molaritet.
Referanser
- Wikipedia. (s.f.). Colligative egenskaper. Hentet fra en.wikipedia.org
- F.Kr. (s.f.). Colligative egenskaper. Gjenopprettet fra opentextbc.ca
- Bosma, W. B. (s.f.). Colligative egenskaper. Hentet fra chemistryexplained.com
- Sparknoter. (s.f.). Colligative egenskaper. Gjenopprettet fra sparknotes.com
- University, F. S. (s.f.). Colligative egenskaper. Hentet fra chem.fsu.edu

Ingen har kommentert denne artikkelen ennå.