
Fysiske og kjemiske egenskaper til metaller

De egenskaper av metaller, Både fysiske og kjemiske, de er nøkkelen til konstruksjonen av utallige gjenstander og ingeniørarbeider, samt dekorative ornamenter i forskjellige kulturer og feiringer..
Siden uminnelige tider har de vekket nysgjerrighet for sitt attraktive utseende, i motsetning til bergartens ugjennomsiktighet. Noen av disse mest verdsatte egenskapene er høy motstandsdyktighet mot korrosjon, lav tetthet, stor hardhet og seighet og elastisitet, blant andre..

I kjemi er han mer interessert i metaller fra et atomperspektiv: oppførselen til deres ioner mot organiske og uorganiske forbindelser. På samme måte kan salter fremstilles av metaller beregnet for meget spesifikke bruksområder; for eksempel kobber- og gullsalter.
Imidlertid var det de fysiske egenskapene som først fanget menneskeheten. De er generelt preget av å være holdbare, noe som spesielt gjelder for edle metaller. Dermed ble alt som lignet gull eller sølv ansett som verdifullt; mynter, juveler, juveler, lenker, statuer, tallerkener etc. ble laget.
Metaller er de vanligste elementene i naturen. Bare ta en titt på det periodiske systemet for å bekrefte at nesten alle elementene er metalliske. Takket være dem var det materiale tilgjengelig for å lede elektrisk strøm innen elektroniske enheter; det vil si at de er teknikkens arterier og bygninger.
Artikkelindeks
- 1 Metallers fysiske egenskaper
- 1.1 Strålende
- 1.2 Hardhet
- 1.3 Smidbarhet
- 1.4 Duktilitet
- 1.5 Termisk og elektrisk ledningsevne
- 1.6 Loudness
- 1.7 Høye smelte- og kokepunkter
- 1.8 Legeringer
- 2 Kjemiske egenskaper
- 2.1 Strukturer og lenker
- 2.2 Korrosjon
- 2.3 Reduksjonsmidler
- 2.4 Reaktivitet
- 3 Referanser
Fysiske egenskaper til metaller
De fysiske egenskapene til metaller er de som definerer og skiller dem som materialer. Det er ikke nødvendig at de gjennomgår noen transformasjon forårsaket av andre stoffer, men ved fysiske handlinger som å varme dem opp, deformere dem, polere dem eller bare se på dem..
Strålende
De aller fleste metaller er blanke, og har også grå eller sølvfarger. Det er noen unntak: kvikksølv er svart, kobber er rødlig, gullgull og osmium viser noen blåfarger. Denne lysstyrken skyldes samspillet mellom fotoner og overflaten elektronisk avlokalisert av metallbindingen..

Hardhet
Metaller er harde, bortsett fra alkaliske og noen andre. Dette betyr at en metallstang vil være i stand til å skrape overflaten den berører. Når det gjelder alkalimetaller, som rubidium, er de så myke at de kan skrapes av med en negl; i det minste før de begynner å korrodere kjøttet.
Formbarhet
Metaller er vanligvis formbare ved forskjellige temperaturer. Når de blir slått, og hvis de blir deformert eller knust uten å sprekke eller smuldre, sies det at metallet er formbart og viser smidighet. Ikke alle metaller er formbare.
Duktilitet
Metaller, i tillegg til å være formbare, kan være duktile. Når et metall er duktilt, er det i stand til å gjennomgå deformasjoner i samme retning og bli som om det var en tråd eller ledning. Hvis det er kjent at et metall kan handles i kabelhjul, kan vi si at det er et duktilt metall; for eksempel kobber- og gulltråder.

Termisk og elektrisk ledningsevne
Metaller er gode ledere av både varme og elektrisitet. Blant de beste varmeledere har vi aluminium og kobber; mens de som leder elektrisitet best er sølv, kobber og gull. Derfor er kobber et metall som er høyt verdsatt i bransjen for sin utmerkede termiske og elektriske ledningsevne..

Sonority
Metaller er lydmaterialer. Hvis to metalldeler treffes, produseres en karakteristisk lyd for hvert metal. Eksperter og elskere av metaller er faktisk i stand til å skille dem ved lyden de avgir.
Høye smelte- og kokepunkter
Metaller tåler høye temperaturer før smelting. Noen metaller, som wolfram og osmium, smelter ved henholdsvis 3422 ºC og 3033 ºC. Imidlertid smelter sink (419,5 ° C) og natrium (97,79 ° C) ved veldig lave temperaturer..
Blant alle er cesium (28,44 ºC) og gallium (29,76 ºC) de som smelter ved laveste temperatur.
Fra disse verdiene kan man få en idé om hvorfor en elektrisk lysbue brukes i sveiseprosesser og intense blink blir forårsaket..
På den annen side indikerer selve de høye smeltepunktene at alle metaller er faste ved romtemperatur (25 ºC); bortsett fra kvikksølv, det eneste metallet og et av de få kjemiske elementene som er flytende.

Legeringer
Selv om det ikke er en slik fysisk egenskap, kan metaller blandes med hverandre, så lenge atomer klarer å tilpasse seg for å skape legeringer. Dette er altså faste blandinger. Ett par metaller kan legeres lettere enn et annet; og noen kan faktisk ikke legeres i det hele tatt på grunn av den lave affiniteten mellom dem.
Kobber "kommer overens" med tinn, blandes med det for å danne bronse; eller med sink, for å danne messing. Legeringer tilbyr flere alternativer når metaller alene ikke kan oppfylle de nødvendige egenskapene for en applikasjon; som når du vil kombinere et metalls letthet med et annet tetthet.
Kjemiske egenskaper
Kjemiske egenskaper er de som ligger i atomene og hvordan de samhandler med molekyler utenfor miljøet for å slutte å være metaller, for å bli andre forbindelser (oksider, sulfider, salter, organometalliske komplekser, etc.). Det handler da om deres reaktivitet og deres strukturer.
Strukturer og lenker
Metaller, i motsetning til ikke-metalliske elementer, er ikke gruppert som molekyler, M-M, men som et nettverk av M-atomer som er sammenhengende av deres eksterne elektroner.
I denne forstand forblir metallatomene sterkt forent av et "hav av elektroner" som bader dem, og de går overalt; det vil si at de er avlokalisert, de er ikke festet i noen kovalent binding, men de utgjør den metalliske bindingen. Dette nettverket er veldig ryddig og repeterende, så vi har metalliske krystaller.
Metallkrystaller, av forskjellige størrelser og fulle av ufullkommenheter, og deres metallbinding, er ansvarlige for de observerte og målte fysiske egenskapene for metaller. Det faktum at de er fargerike, lyse, gode ledere og lyd, alt skyldes strukturen og elektronisk flytting.
Det er krystaller der atomene er mer komprimert enn andre. Derfor kan metaller være like tette som bly, osmium eller iridium; eller så lett som litium, til og med i stand til å flyte på vann før du reagerer.
Korrosjon
Metaller er utsatt for korrodering; selv om flere av dem unntaksvis kan motstå det under normale forhold (edle metaller). Korrosjon er en progressiv oksidasjon av metalloverflaten, som ender opp med å smuldre opp, forårsaker flekker og hull som ødelegger den skinnende overflaten, så vel som andre uønskede farger..

Metaller som titan og iridium har høy korrosjonsmotstand, siden laget av deres dannede oksider ikke reagerer med fuktighet, og de lar heller ikke oksygen trenge gjennom det indre av metallet. Og av de enkleste metaller å korrodere har vi jern, hvis rust er ganske gjenkjennelig med sin brune farge..
Reduksjonsmidler
Noen metaller er utmerkede reduksjonsmidler. Dette betyr at de gir opp elektronene sine til andre elektron-sultne arter. Resultatet av denne reaksjonen er at de ender opp med å bli kationer, Mn+, hvor n er oksidasjonstilstanden til metallet; det vil si den positive ladningen, som kan være flerverdig (større enn 1+).
For eksempel brukes alkalimetaller for å redusere noen oksider eller klorider. Når dette skjer med natrium, Na, mister det sitt eneste valenselektron (fordi det tilhører gruppe 1) for å bli et natriumion eller kation, Na+ (monovalent).
Tilsvarende med kalsium, Ca (gruppe 2), som mister to elektroner i stedet for bare en og forblir som en toverdig kation Cato+.
Metaller kan brukes som reduksjonsmidler fordi de er elektropositive elementer; de er mer sannsynlig å gi opp elektronene sine enn å få dem fra andre arter.
Reaktivitet
Når det er sagt at elektroner har en tendens til å miste elektroner, kan det forventes at de i alle reaksjonene (eller de fleste) ender opp med å transformere til kationer. Nå samhandler disse kationene tilsynelatende med anioner for å generere et bredt spekter av forbindelser..
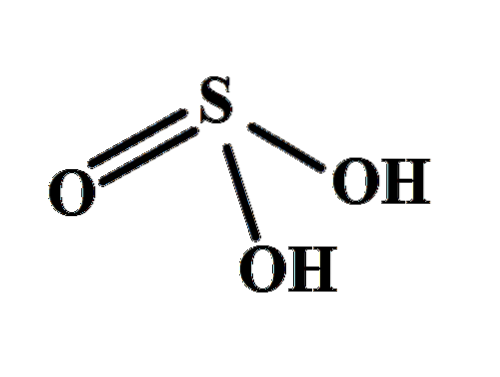
For eksempel reagerer jord- og jordalkalimetaller direkte (og eksplosivt) med vann for å danne hydroksider, M (OH)n, dannet av M-ionern+ og OH-, eller ved M-OH obligasjoner.
Når metaller reagerer med oksygen ved høye temperaturer (som de som nås av en flamme), forvandles de til oksider MtoELLERn (NatoO, CaO, MgO, AltoELLER3, etc.). Dette er fordi vi har oksygen i luften; men også nitrogen, og noen metaller kan danne en blanding av oksider og nitrider, M3Nn (TiN, AlN, GaN, Be3Nto, Ag3N, etc.).
Metaller kan angripes av sterke syrer og baser. I det første tilfellet oppnås salter, og i det andre igjen hydroksider eller basiske komplekser.
Oksydlaget som dekker noen metaller hindrer syrer i å angripe metallet. For eksempel kan ikke saltsyre oppløse alle metaller som danner deres respektive metallklorider, oppløselige i vann..
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Hjemmefaglige verktøy. (2019). Metals Science Lesson. Gjenopprettet fra: learning-center.homesciencetools.com
- Rosen Publishing Group. (2019). Metaller. Gjenopprettet fra: pkphysicalscience.com
- Toppr. (s.f.). Kjemiske egenskaper til metaller og ikke-metaller. Gjenopprettet fra: toppr.com
- Wikipedia. (2019). Metall. Gjenopprettet fra: en.wikipedia.org


Ingen har kommentert denne artikkelen ennå.