
Etyleteregenskaper, struktur, produksjon, bruksområder
De etyleter, også kjent som dietyleter, det er en organisk forbindelse hvis kjemiske formel er C4H10O. Det kjennetegnes ved å være en fargeløs og flyktig væske, og derfor bør flaskene holdes lukket så tett som mulig.
Denne eteren er klassifisert som et medlem av dialkyletrene; det vil si at de har formelen ROR ', hvor R og R' representerer forskjellige karbonsegmenter. Og som beskrevet med sitt andre navn, dietyleter, er det to-etylradikaler som binder seg til oksygenatomet.

Etyleter ble opprinnelig brukt som generell bedøvelse, introdusert i 1846 av William Thomas Green Morton. På grunn av dets brennbarhet ble imidlertid bruken kastet, og erstattet den med andre mindre farlige bedøvelsesmidler..
Denne forbindelsen har også blitt brukt til å estimere tidspunktet for blodsirkulasjonen under evaluering av kardiovaskulær status hos pasienter..
Innen kroppen kan dietyleter transformeres til karbondioksid og metabolitter; sistnevnte ender med å bli utskilt i urinen. Imidlertid blir det meste av administrert eter pustet ut i lungene, uten å gjennomgå noen modifikasjon..
På den annen side brukes den som løsningsmiddel for såper, oljer, parfymer, alkaloider og tannkjøtt..
Artikkelindeks
- 1 Struktur av etyleter
- 1.1 Intermolekylære krefter
- 2 Fysiske og kjemiske egenskaper
- 2.1 Andre navn
- 2.2 Molekylformel
- 2.3 Molekylvekt
- 2.4 Fysisk utseende
- 2,5 Lukt
- 2.6 Smak
- 2.7 Kokepunkt
- 2.8 Smeltepunkt
- 2.9 Flammepunkt
- 2.10 Løselighet i vann
- 2.11 Løselighet i andre væsker
- 2.12 Tetthet
- 2.13 Damptetthet
- 2.14 Damptrykk
- 2.15 Stabilitet
- 2.16 Selvantennelse
- 2.17 Nedbrytning
- 2.18 Viskositet
- 2.19 Forbrenningsvarme
- 2.20 Fordampningsvarme
- 2.21 Overflatespenning
- 2.22 Ioniseringspotensial
- 2,23 Luktterskel
- 2.24 Brytningsindeks
- 3 Motta
- 3.1 Fra etylalkohol
- 3.2 Fra etylen
- 4 Toksisitet
- 5 bruksområder
- 5.1 Organisk løsemiddel
- 5.2 Generell anestesi
- 5.3 Eterens ånd
- 5.4 Vurdering av blodsirkulasjonen
- 5.5 Undervisningslaboratorier
- 6 Referanser
Struktur av etyleter
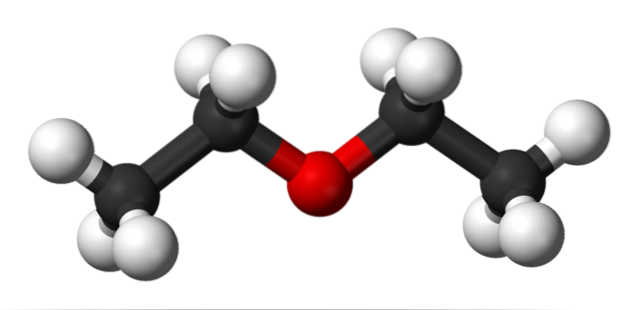
I det øvre bildet er det en representasjon med en modell av kuler og stenger av molekylstrukturen til etyleter..
Som man kan se, har den røde sfæren, som tilsvarer oksygenatomet, to etylgrupper knyttet på begge sider. Alle koblingene er enkle, fleksible og roterer fritt rundt σ-aksene.
Disse rotasjonene gir opphav til stereoisomerer kjent som konformere; at mer enn isomerer, er de alternative romlige tilstander. Bildestrukturen tilsvarer nøyaktig anti-konformatoren, der alle gruppene av atomer er forskjøvet (atskilt fra hverandre).
Hva ville den andre konformisten være? Den formørkede, og selv om bildet ikke er tilgjengelig, er det nok å visualisere det i U-form. I de øvre endene av U er metylgruppene, -CH3, som vil oppleve steriske frastøtelser (kolliderer i rommet).
Derfor forventes det at CH-molekylet3CHtoOCHtoCH3 vedta anti-forming mesteparten av tiden.
Intermolekylære krefter
Ved hvilke intermolekylære krefter styres etyletermolekylene i væskefasen? De holdes i væsken hovedsakelig takket være dispersjonskrefter, siden dipolmomentet (1.5D) mangler et tilstrekkelig mangelfullt område i elektrontetthet (δ +)
Dette er fordi intet karbonatom i etylgruppene gir opp for mye elektrondensitet til oksygenatomet. Det nevnte er tydelig med det elektrostatiske potensialet kart over etyleter ved hånden (nedre bilde). Legg merke til fraværet av en blå region.
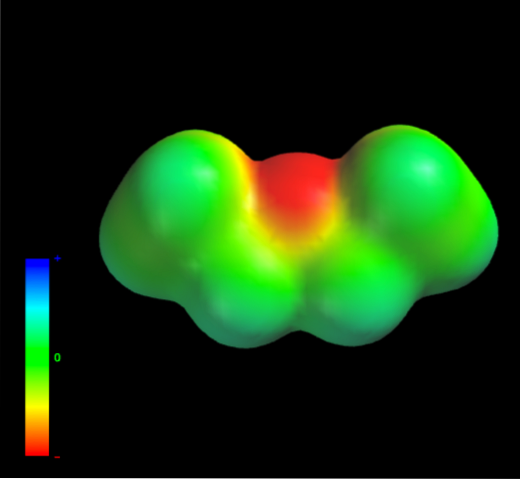
Oksygen kan heller ikke danne hydrogenbindinger, igjen, fordi det ikke er noen O-H-bindinger tilgjengelig i molekylstrukturen. Derfor er det de øyeblikkelige dipolene og deres molekylære masse som favoriserer deres spredningskrefter..
Til tross for dette er det svært løselig i vann. Hvorfor? Fordi oksygenatomet, med høyere elektrondensitet, kan akseptere hydrogenbindinger fra et vannmolekyl:
(CH3CHto)toELLERδ- - δ+H-OH
Disse interaksjonene er ansvarlige for at 6,04 g av denne eteren oppløses i 100 ml vann.
Fysiske og kjemiske egenskaper
Andre navn
-Dietyleter
-Etoksyetan
-Etyloksid
Molekylær formel
C4H10O eller (CtoH5)toELLER.
Molekylær vekt
74,14 g / mol.
Fysisk utseende
Fargeløs væske.
Lukt
Søt og krydret.
Smak
Brennende og søt.
Kokepunkt
94,6 ºF (34,6 ºC) ved 760 mmHg.
Smeltepunkt
-177,3 ° F (-116,3 ° C). Stabile krystaller.
antennelsespunkt
-49ºF (lukket beholder).
Vannløselighet
6,04 g / 100 ml ved 25 ºC.
Løselighet i andre væsker
Blandbar med kortkjedede alifatiske alkoholer, benzen, kloroform, petroleumeter, fettløsningsmiddel, mange oljer og konsentrert saltsyre.
Løselig i aceton og veldig løselig i etanol. Det er også løselig i nafta, benzen og oljer.
Tetthet
0,714 mg / ml ved 68 CF (20 ºC).
Damptetthet
2,55 (i forhold til luft tatt med tetthet 1).
Damptrykk
442 mmHg ved 68ºF. 538 mmHg ved 25 ° C. 58,6 kPa ved 20 ºC.
Stabilitet
Det oksyderes sakte av luft, fuktighet og lys med dannelsen av peroksider.
Dannelsen av peroksider kan forekomme i eterbeholdere som har blitt åpnet og som er lagret i mer enn seks måneder. Peroksider kan detoneres ved friksjon, støt eller oppvarming.
Unngå kontakt med: sink, halogener, ikke-metalliske oksyhalogenider, sterke oksidasjonsmidler, kromylklorid, tementinoljer, metallnitrater og klorider.
Selvantennelse
356 ºF (180 ºC).
Nedbrytning
Ved oppvarming brytes den ned og avgir skarp og irriterende røyk.
Viskositet
0,2448 cPoise ved 20 ºC.
Forbrenningsvarme
8,807 Kcal / g.
Fordampningsvarme
89,8 cal / g ved 30 ºC.
Overflatespenning
17.06 dynes / cm ved 20 ° C.
Ioniseringspotensial
9,53 eV.
Luktterskel
0,83 ppm (renhet er ikke gitt).
Brytningsindeks
1.355 ved 15 ºC.
Å skaffe
Fra etylalkohol
Etyleter kan fås fra etylalkohol i nærvær av svovelsyre som katalysator. Svovelsyre i et vandig medium dissosierer og produserer hydroniumionet, H3ELLER+.
Den vannfrie etylalkoholen strømmer gjennom svovelsyreløsningen, oppvarmet mellom 130 ° C og 140 ° C, og gir protonering av etylalkoholmolekyler. Deretter reagerer et annet ikke-protonert etylalkoholmolekyl med det protonerte molekylet.
Når dette skjer, fremmer det nukleofile angrepet i det andre etylalkoholmolekylet frigjøring av vann fra det første molekylet (det protonerte); som et resultat ble en protonert etyleter (CH3CHtoOHCHtoCH3), med delvis positivt ladet oksygen.
Imidlertid mister denne syntesemetoden effektiviteten fordi svovelsyren gradvis fortynnes med vannet som produseres i prosessen (produkt av dehydrering av etylalkohol)..
Reaksjonstemperaturen er kritisk. Ved temperaturer under 130 ° C er reaksjonen treg, og etylalkohol vil destilleres for det meste..
Over 150 ºC forårsaker svovelsyre dannelsen av etylen (dobbeltbindingsalkenet), i stedet for å kombinere med etylalkohol for å danne etyleter.
Fra etylen
I omvendt prosess, det vil si hydrering av etylen i dampfasen, kan etyleter dannes som et biprodukt i tillegg til etylalkohol. Faktisk produserer denne syntetiske ruten det meste av denne organiske forbindelsen..
Denne prosessen bruker fosforsyrekatalysatorer festet til en fast bærer, som kan justeres for å produsere mer eter..
Dampfase dehydrering av etanol i nærvær av aluminiumoksydkatalysatorer kan gi et utbytte på 95% ved produksjon av etyleter..
Toksisitet
Kan forårsake hud- og øyeirritasjon ved kontakt. Kontakt med huden kan forårsake tørking og sprekker. Eter trenger vanligvis ikke inn i huden, da det raskt fordampes.
Øyeirritasjon forårsaket av eter er vanligvis mild, og i tilfelle alvorlig irritasjon er skaden generelt reversibel.
Inntaket gir narkotiske effekter og irritasjon i magen. Alvorlig svelging kan forårsake nyreskade.
Innånding av eter kan forårsake irritasjon i nese og hals. Ved innånding av eter kan følgende forekomme: døsighet, spenning, svimmelhet, oppkast, uregelmessig pust og økt salivasjon..
Høy eksponering kan føre til tap av bevissthet og til og med død.
OSHA setter en luftbåren yrkeseksponeringsgrense på 800 ppm i gjennomsnitt over et 8-timers skift..
Øyeirritasjonsnivåer: 100 ppm (menneske). Øyeirritasjonsnivåer: 1200 mg / m3 (400 spm).
applikasjoner
Organisk løsemiddel
Det er et organisk løsningsmiddel som brukes til å oppløse brom, jod og andre halogener; de fleste lipider (fettstoffer), harpikser, rene gummier, noen alkaloider, tannkjøtt, parfymer, celluloseacetat, cellulosenitrat, hydrokarboner og fargestoffer.
I tillegg brukes den til ekstraksjon av aktive bestanddeler fra dyre- og plantevev, fordi den har lavere tetthet enn vann og flyter på den, og etterlater de ønskede stoffene oppløst i eteren..
Generell anestesi
Det har blitt brukt som generell bedøvelse siden 1840, og erstatter kloroform ettersom det har en terapeutisk fordel. Imidlertid er det et brennbart stoff, og støter derfor på alvorlige vanskeligheter i bruken innen kliniske omgivelser..
I tillegg gir det noen uønskede postoperative bivirkninger som kvalme og oppkast hos pasienter..
Av disse grunner har bruken av eter som generell bedøvelse blitt kastet, og erstattet den med andre bedøvelsesmidler som halotan..
Ether Spirit
Eter blandet med etanol ble brukt til å danne oppløsningen kalt spirit of eter, brukt til behandling av gastrisk flatulens og mildere former for gastralgi..
Evaluering av blodsirkulasjonen
Ether har blitt brukt til å evaluere blodsirkulasjonen mellom en arm og lungene. Ether injiseres i en arm, og fører blodet til høyre atrium, deretter høyre ventrikkel, og derfra til lungene..
Tiden som går fra injeksjonen av eteren, til fangsten av lukten av eteren i den utåndede luften, er omtrent 4 til 6 s.
Undervisningslaboratorier
Ether brukes i undervisningslaboratorier i mange eksperimenter; for eksempel i demonstrasjonen av Mendels genetiske lover.
Ether brukes til å lukke fluer av slekten Drosophila og tillate de nødvendige kryssene mellom dem, og dermed bevise genetiske lover
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- The Sevier. (2018). Dietyleter. Science Direct. Gjenopprettet fra: sciencedirect.com
- Redaksjonen av Encyclopaedia Britannica. (2018). Etyleter. ncyclopædia Britannica. Gjenopprettet fra: britannica.com
- PubChem (2018). Ether. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Dietyleter. Gjenopprettet fra: en.wikipedia.org
- Sikkerhetsark XI: etyleter. [PDF]. Gjenopprettet fra: quimica.unam.mx


Ingen har kommentert denne artikkelen ennå.