
Hva er fordampning?

De fordampning er prosessen med å omdanne et kjemisk stoff fra en flytende eller fast tilstand til en gass- eller damptilstand. Andre begreper som brukes for å beskrive den samme prosessen er fordampning, destillasjon og sublimering..
Ett stoff kan ofte skilles fra et annet ved fordampning og kan deretter gjenvinnes ved dampkondensasjon..

Stoffet kan raskere fordampes ved enten å varme det opp for å øke damptrykket eller ved å fjerne dampen ved hjelp av en inert gasstrøm eller en vakuumpumpe..
Oppvarmingsprosedyrer inkluderer fordampning av vann, kvikksølv eller arseniklorid for å skille disse stoffene fra forstyrrende elementer..
Kjemiske reaksjoner brukes noen ganger for å produsere flyktige produkter som ved frigjøring av karbondioksid fra karbonater, ammoniakk i Kjeldahl-metoden for bestemmelse av nitrogen og svoveldioksid ved bestemmelse av svovel i stål.
Fordampningsmetodene er generelt preget av stor enkelhet og brukervennlighet, bortsett fra når det er behov for høye temperaturer eller materialer som er svært motstandsdyktige mot korrosjon (Louis Gordon, 2014).
Fordampning av damptrykk
Å vite at vannets koketemperatur er 100 ° C, har du noen gang lurt på hvorfor regnvann fordamper??
Er det 100 ° C? I så fall, hvorfor blir jeg ikke varm? Har du noen gang lurt på hva som gir den karakteristiske aromaen til alkohol, eddik, tre eller plast? (Damptrykk, S.F.)
Ansvarlig for alt dette er en egenskap kjent som damptrykk, som er trykket som utøves av en damp i likevekt med den faste eller flytende fase av samme substans..
Også partielt trykk av stoffet i atmosfæren på det faste stoffet eller væsken (Anne Marie Helmenstine, 2014).
Damptrykk er et mål på tendensen til et materiale til å endre seg til gass eller damptilstand, det vil si et mål på stoffets flyktighet.
Når damptrykket øker, desto større er evnen til væske eller fast stoff til å fordampe, og blir dermed mer flyktig..
Damptrykket vil øke med temperaturen. Temperaturen der damptrykket på overflaten av en væske tilsvarer trykket som utøves av miljøet kalles væskens kokepunkt (Encyclopædia Britannica, 2017).
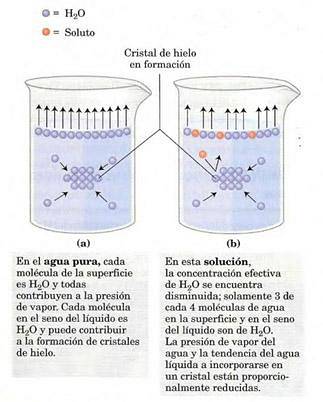
Damptrykket vil avhenge av det oppløste stoffet oppløst i oppløsning (det er en kolligativ egenskap). På overflaten av løsningen (luft-gass-grensesnitt) har de mest overfladiske molekylene en tendens til å fordampe, bytter mellom faser og genererer et damptrykk..
Tilstedeværelsen av løsemiddel reduserer antall løsningsmiddelmolekyler ved grensesnittet, og reduserer damptrykket..
Endringen i damptrykk kan beregnes med Raoults lov for ikke-flyktige oppløste stoffer, gitt av:
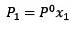
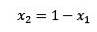
Hvor X2 er molfraksjonen av løsningsmidlet. Hvis vi multipliserer begge sider av ligningen med P °, forblir den:
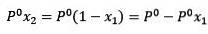
Å erstatte (1) i (3) er:
(4)
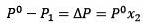
Dette er variasjonen i damptrykk når en løsemiddel oppløses (Jim Clark, 2017).
Gravimetrisk analyse
Gravimetrisk analyse er en klasse laboratorieteknikker som brukes til å bestemme massen eller konsentrasjonen av et stoff ved å måle en endring i masse..
Kjemikaliet vi prøver å kvantifisere kalles noen ganger analyt. Vi kunne bruke gravimetrisk analyse for å svare på spørsmål som:
- Hva er konsentrasjonen av analytten i en løsning?
- Hvor rent er prøven vår? Prøven her kan være en solid eller i løsning.
Det er to vanlige typer gravimetrisk analyse. Begge involverer å endre fasen av analyten for å skille den fra resten av en blanding, noe som fører til en endring i masse..
En av disse metodene er nedbørgravimetri, men den vi virkelig er interessert i er fordampning av gravimetri.
Fordampningsgravimetri er basert på termisk eller kjemisk nedbrytning av prøven og måling av den resulterende endringen i massen..
Alternativt kan vi fange opp og veie et flyktig nedbrytningsprodukt. Fordi utslipp av en flyktig art er en vesentlig del av disse metodene, klassifiserer vi dem samlet som flyktiggjørende gravimetriske analysemetoder (Harvey, 2016).
Gravimetriske analyseproblemer er rett og slett støkiometriproblemer med noen få ekstra trinn.
For å utføre en støkiometrisk beregning trenger vi koeffisientene til den balanserte kjemiske ligningen.
For eksempel, hvis en prøve inneholder bariumkloriddihydrat (BaClto● HtoO), kan mengden urenheter oppnås ved å varme opp prøven for å fordampe vannet.
Forskjellen i masse mellom den opprinnelige prøven og den oppvarmede prøven vil gi oss, i gram, mengden vann i bariumkloridet.
Med en enkel støkiometrisk beregning vil mengden urenheter i prøven oppnås (Khan, 2009).
Fraksjonert destillasjon
Fraksjonell destillasjon er en prosess der komponentene i en flytende blanding skilles i forskjellige deler (kalt fraksjoner) i henhold til forskjellige kokepunkter.
Forskjellen i flyktighet av forbindelsene i blandingen spiller en grunnleggende rolle i separasjonen..
Fraksjonell destillasjon brukes til å rense kjemikalier og også for å skille blandinger for å oppnå komponentene. Den brukes som laboratorieteknikk og i industrien, der prosessen er av stor kommersiell betydning.
Damp fra en kokende løsning føres gjennom en høy kolonne, kalt en fraksjoneringskolonne..
Kolonnen er pakket med plast- eller glassperler for å forbedre separasjonen ved å gi mer overflateareal for kondens og fordampning.
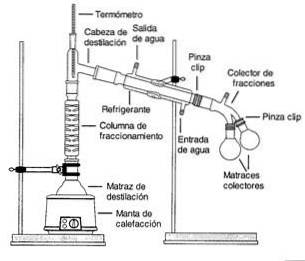
Kolonnens temperatur synker gradvis langs lengden. Komponenter med høyere kokepunkt kondenserer i kolonnen og går tilbake til løsning.
Komponenter med lavere kokepunkter (mer flyktige) passerer gjennom kolonnen og samles nær toppen.
Teoretisk forbedrer separasjonen med flere perler eller plater, men å legge til plater øker også tiden og energien som kreves for å fullføre en destillasjon (Helmenstine, 2016)..
Referanser
- Anne Marie Helmenstine. (2014, 16. mai). Definisjon av damptrykk. Gjenopprettet fra thoughtco.com.
- Encyclopædia Britannica. (2017, 10. februar). Damptrykk. Gjenopprettet fra britannica.com.
- Harvey, D. (2016, 25. mars). Volatilization Gravimetry. Gjenopprettet fra chem.libretexts.
- Helmenstine, A. M. (2016, 8. november). Fraksjonell destillasjonsdefinisjon og eksempler. Gjenopprettet fra thoughtco.com.
- Jim Clark, I. L. (2017, 3. mars). Raoults lov. Gjenopprettet fra chem.libretexts.
- Khan, S. (2009, 27. august). Introduksjon til gravimetrisk analyse: Volatilization gravimetry. Gjenopprettet fra khanacademy.
- Louis Gordon, R. W. (2014). Gjenopprettet fra accessscience.com.
- Damptrykk. (S.F.). Gjenopprettet fra chem.purdue.edu.


Ingen har kommentert denne artikkelen ennå.