
Hva er en mettet løsning? (med eksempler)

EN mettet løsning Det er en kjemisk løsning som inneholder den maksimale konsentrasjonen av oppløst stoff oppløst i et løsningsmiddel. Det betraktes som en tilstand av dynamisk likevekt der hastighetene hvor løsningsmidlet løser opp løsemidlet og omkrystalliseringshastigheten er like (J., 2014).
Tilleggsoppløsningen vil ikke oppløses i en mettet oppløsning og vil vises i en annen fase, enten et bunnfall hvis det er et fast stoff i væske eller et brus hvis det er en gass i en væske (Anne Marie Helmenstine, 2016).
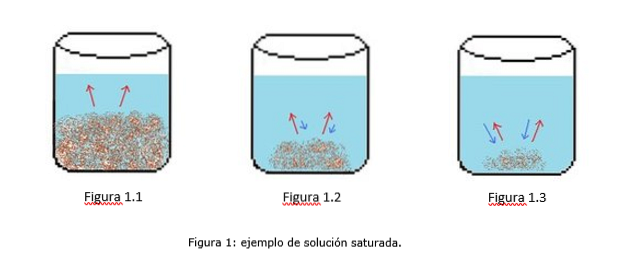
Et eksempel på en mettet løsning er illustrert i figur 1. I figur 1.1, 1.2 og 1.3 er det et konstant vannvolum i begeret. I figur 1.1 begynner metningsprosessen, hvor løsemidlet begynner å oppløses, representert av de røde pilene.
I figur 1.2 er mye av det faste stoffet oppløst, men ikke helt på grunn av omkrystalliseringsprosessen, representert ved de blå pilene..
I figur 1.3 er bare en liten mengde oppløst stoff uoppløst. I dette tilfellet er omkrystallisasjonshastigheten større enn oppløsningshastigheten. (metninger, metning, 2014)
Poenget med maksimal konsentrasjon av et oppløst stoff i et løsningsmiddel er kjent som metningspunktet.
Artikkelindeks
- 1 Faktorer som påvirker metning
- 1.1 Temperatur
- 1.2 Trykk
- 1.3 Kjemisk sammensetning
- 1.4 Mekaniske faktorer
- 2 Metning og løselighetskurver
- 3 Eksempler på mettede løsninger
- 4 Hva er en overmettet løsning?
- 5 Referanser
Faktorer som påvirker metning
Mengden løsemiddel som kan oppløses i et løsningsmiddel, vil avhenge av forskjellige faktorer, blant dem de viktigste er:
Temperatur
Løselighet øker med temperaturen. For eksempel kan mer salt oppløses i varmt vann enn i kaldt vann..
Imidlertid kan det være unntak, for eksempel avtar løseligheten av gasser i vann med økende temperatur. I dette tilfellet får de oppløste molekylene kinetisk energi når de varmes opp, noe som letter deres flukt..
Press
Økt trykk kan tvinge oppløst oppløsning. Dette brukes ofte til å oppløse gasser i væsker..
Kjemisk oppbygning
Løseligheten og løsningen og tilstedeværelsen av andre kjemiske forbindelser i løsningen påvirker løseligheten. For eksempel kan mer sukker oppløses i vann enn salt i vann. I dette tilfellet sies det at sukker er mer løselig.
Etanol i vann er helt løselig med hverandre. I dette spesielle tilfellet vil løsningsmidlet være forbindelsen som finnes i størst mengde.
Mekaniske faktorer
I motsetning til oppløsningshastigheten, som hovedsakelig avhenger av temperaturen, avhenger omkrystallisasjonshastigheten av den oppløste konsentrasjonen på overflaten av krystallgitteret, noe som er favorisert når en løsning er urørlig.
Derfor, omrøring av løsningen unngår denne akkumuleringen, maksimerer oppløsningen (metningstopper, 2014).
Metning og løselighetskurver
Løselighetskurvene er en grafisk database hvor mengden løsemiddel som oppløses i en mengde løsemiddel sammenlignes, ved en viss temperatur.
Løselighetskurver er ofte tegnet for en mengde løst stoff, enten fast eller gass, i 100 gram vann (Brian, 2014).
Figur 2 illustrerer metningskurvene for forskjellige oppløste stoffer i vann..
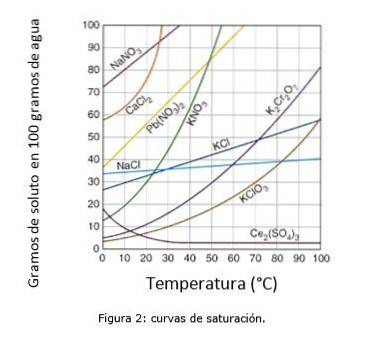
På aksen til koordinatene har vi temperaturen i grader Celsius, og på aksen til abscissen har vi konsentrasjonen av oppløst stoff uttrykt i gram oppløst stoff per 100 gram vann.
Kurven indikerer metningspunktet ved en gitt temperatur. Området under kurven indikerer at du har en umettet løsning og derfor kan mer løsemiddel tilsettes..
Området over kurven har en overmettet løsning. (Løselighetskurver, n.d.)
Tar vi natriumklorid (NaCl) som et eksempel, ved 25 ° C kan ca. 35 gram NaCl oppløses i 100 gram vann for å oppnå en mettet løsning. (Cambrige University, s.f.)
Eksempler på mettede løsninger
Mettet løsninger kan bli funnet på en daglig basis, det er ikke nødvendig å være i et kjemisk laboratorium. Løsningsmidlet trenger ikke nødvendigvis å være vann. Nedenfor er hverdagseksempler på mettede løsninger:
-Brus og brus generelt er mettede oppløsninger av karbondioksid i vann. Det er derfor, når trykket frigjøres, dannes bobler av karbondioksid..
-Jordjord er mettet med nitrogen.
-Sukker eller salt kan tilsettes eddiken for å danne en mettet løsning..
-Tilsett pulverisert sjokolade i melk til den ikke løser seg, den danner en mettet løsning.
-Melk kan være mettet med mel i en slik grad at det ikke kan tilsettes mer mel i melken.
-Smeltet smør kan være mettet med salt når saltet ikke lenger løser seg opp.
Hva er en overmettet løsning?
Definisjonen av en overmettet løsning er en som inneholder mer oppløst oppløst stoff enn det som normalt kunne oppløses i løsningsmidlet. Dette gjøres vanligvis ved å øke temperaturen i løsningen..
En liten endring av løsningen eller innføring av et "frø" eller en liten, oppløst krystall vil tvinge ut krystallisering av overflødig løsemiddel. Hvis det ikke er noe kjernepunkt for krystalldannelse, kan overflødig løsemiddel forbli i løsning.
En annen form for overmetting kan oppstå når en mettet oppløsning avkjøles forsiktig. Denne endringen i forhold betyr at konsentrasjonen faktisk er høyere enn metningspunktet, løsningen er overmettet..
Dette kan brukes i omkrystalliseringsprosessen for å rense et kjemikalie: det oppløses til metningspunkt i varmt løsningsmiddel, deretter når løsningsmidlet avkjøles og løseligheten avtar, overskudd av løselig utfelling.
Urenheter, som er tilstede i en mye lavere konsentrasjon, metter ikke løsningsmidlet og forblir således oppløst i væsken.
Referanser
- Anne Marie Helmenstine, P. (2016, 7. juli). Mettet løsningsdefinisjon og eksempler. Hentet fra ca: about.com
- Cambrige University. (s.f.). Løselighetskurver. Hentet fra dynamicscience.com: dynamicscience.com.au.
- Eksempler på mettet løsning. (s.f.). Hentet fra din ordfører: examples.yourdictionary.com.
- , S. (2014, 4. juni). Mettede og overmettede løsninger. Hentet fra socratic.org: socratic.org.
- James, N. (s.f.). Mettet løsning: Definisjon og eksempler. Hentet fra study.com: study.com.
- , B. (2014, 14. oktober). Mettede og overmettede løsninger. Hentet fra socratic.org: socratic.org.
- Løselighetskurver. (s.f.). Hentet fra KentChemistry: kentchemistry.com.
- Metninger av metning. (2014, 26. juni). Hentet fra kjemi libretex: chem.libretexts.org.


Ingen har kommentert denne artikkelen ennå.