
Hva er degenererte orbitaler?
De degenererte orbitaler de er alle de som er på samme energinivå. I henhold til denne definisjonen må de ha samme hovedkvantetall n. Dermed er 2s og 2p orbitalene degenererte, siden de tilhører energinivå 2. Det er imidlertid kjent at deres vinkel- og radiale bølgefunksjoner er forskjellige.
Som verdiene til n, elektronene begynner å okkupere andre energinivåer, for eksempel d- og f-orbitalene. Hver av disse orbitalene har sine egne egenskaper, som ved første øyekast kan sees i sine vinkelformer; Dette er sfæriske (s), manualer (p), kløverblader (d) og kuleformede (f) figurer.
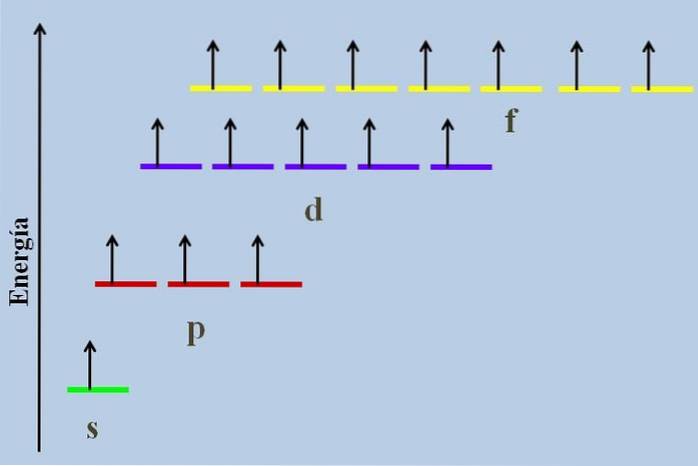
Mellom dem er det en energisk forskjell, selv om de tilhører samme nivå n.
For eksempel viser bildet over et energiskjema med orbitalene okkupert av uparrede elektroner (et unormalt tilfelle). Det kan sees at av alle de mest stabile (den med lavest energi) er ns (1s, 2s, ...) orbital, mens nf er den mest ustabile (den med høyest energi).
Artikkelindeks
- 1 Degenererte orbitaler av et isolert atom
- 1.1 Orbitaler s
- 1.2 Orbitaler d
- 1.3 Orbitaler f
- 2 Degenerate Hybrid Orbitals
- 3 Referanser
Degenererte orbitaler av et isolert atom
Degenererte orbitaler, med samme verdi av n, de er på samme linje i en energiordning. Av denne grunn ligger de tre røde stripene som symboliserer p-orbitalene på samme linje; det samme gjør de lilla og gule stripene på samme måte.
Diagrammet på bildet bryter Hunds regel: orbitalene med høyere energi er fylt med elektroner uten å parre dem først med de lavere energiene. Når elektronene parrer seg, mister orbitalen energi og utøver en større elektrostatisk frastøtning på de uparrede elektronene til de andre orbitalene..
Imidlertid er slike effekter ikke vurdert i mange energidiagrammer. Hvis ja, og adlyde Hunds styre uten å fylle orbitalene fullstendig, ville det bli sett på at de slutter å bli degenererte.
Som tidligere nevnt har hver bane sine egne egenskaper. Et isolert atom, med sin elektroniske konfigurasjon, har elektronene ordnet i det nøyaktige antall orbitaler for å imøtekomme dem. Bare de som har like energi kan betraktes som degenererte.
Orbitaler s
De tre røde stripene for degenererte p-orbitaler i bildet indikerer at begge px, sY Og sz de har samme energi. Det er et uparret elektron i hver, beskrevet av fire kvantetall (n, l, ml Y ms), mens de tre første beskriver orbitalene.
Den eneste forskjellen mellom dem er betegnet med magnetmomentet ml, som trekker banen til sx på en x-akse, sY på y-aksen, og sz på z-aksen. Alle tre er like, men skiller seg bare ut i deres romlige orientering. Av denne grunn blir de alltid tegnet på linje med energi, det vil si utartet.
Siden de er de samme, et isolert nitrogenatom (med 1s-konfigurasjonto2sto2 s3) må holde de tre p-orbitalene degenererte. Imidlertid endres energisscenariet brått hvis man vurderer et N-atom i et molekyl eller en kjemisk forbindelse..
Hvorfor? For selv om sx, sY Og sz de er like i energi, dette kan variere i hver enkelt av dem hvis de har forskjellige kjemiske omgivelser; det vil si hvis de binder seg til forskjellige atomer.
Orbitaler d
Det er fem lilla striper som betegner d-orbitalene. I et isolert atom, selv om de har parrede elektroner, betraktes disse fem orbitalene som degenererte. Imidlertid, i motsetning til p-orbitalene, er det denne gangen en markant forskjell i vinkelformene.
Derfor beveger elektronene retninger i rommet som varierer fra en d-bane til en annen. Dette forårsaker i følge teori for krystallfelt, at en minimum forstyrrelse forårsaker a splitting av energi av orbitalene; det vil si at de fem lilla stripene skiller seg, og etterlater et energigap mellom seg:
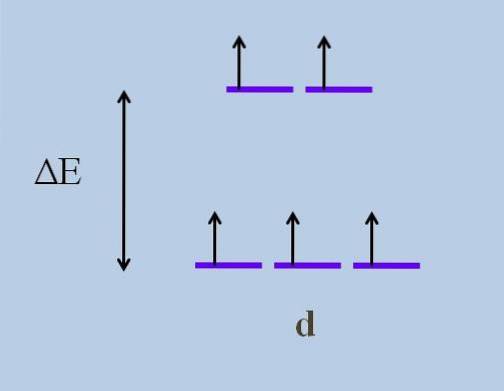
Hva er de øverste orbitalene og hva er de nedre orbitalene? De ovennevnte er symbolisert som ogg, og de nedenfor t2 g. Legg merke til hvordan opprinnelig alle de lilla stripene ble justert, og nå ble det dannet et sett med to orbitaler ogg mer energisk enn det andre settet med tre orbitaler t2 g.
Denne teorien lar oss forklare d-d-overgangene, som mange av fargene som er observert i forbindelsene til overgangsmetallene (Cr, Mn, Fe, etc.) tilskrives. Og hva er årsaken til denne elektroniske forstyrrelsen? Til koordineringsinteraksjoner av metallsenteret med andre molekyler som kalles ligander.
Orbitaler f
Og med f orbitalene, de følte gule stripene, blir situasjonen enda mer komplisert. Den romlige retningen varierer mye mellom dem, og visningen av linkene deres blir for kompleks.
Faktisk regnes f-orbitalene for å være så internt kappe at de ikke "deltar nevneverdig" i dannelsen av obligasjoner..
Når det isolerte atomet med f orbitaler omgir seg med andre atomer, begynner interaksjoner og utfolder seg (tap av degenerasjon):
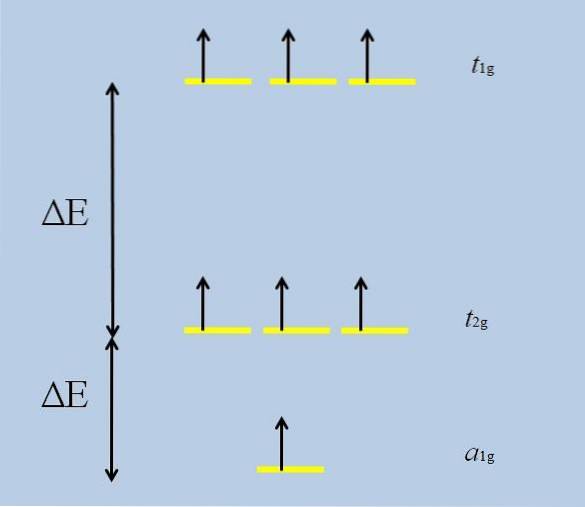
Merk at nå danner de gule stripene tre sett: t1g, t2 g Y til1g, og at de ikke lenger er utartet.
Degenerate Hybrid Orbitals
Det har blitt sett at orbitalene kan utfolde seg og miste degenerasjon. Selv om dette forklarer elektroniske overganger, bleker det imidlertid å belyse hvordan og hvorfor det er forskjellige molekylære geometrier. Dette er hvor hybridorbitaler kommer inn..
Hva er dens viktigste kjennetegn? At de er utartede. Dermed oppstår de fra blandingen av tegn fra orbitaler s, p, d og f, for å stamme degenererte hybrider.
For eksempel blandes tre p-orbitaler med en s for å gi fire sp-orbitaler3. Alle sp-orbitaler3 er degenererte, og har derfor samme energi.
Hvis det i tillegg er to d-orbitaler blandet med de fire sp3, vil du få seks sp-orbitaler3dto.
Og hvordan forklarer de molekylære geometrier? Siden det er seks, med like energi, må de derfor orienteres symmetrisk i rommet for å generere like kjemiske miljøer (for eksempel i en MF-forbindelse6).
Når de gjør det, dannes en koordineringoktaeder, som er lik en oktaedrisk geometri rundt et sentrum (M).
Imidlertid er geometrier ofte forvrengt, noe som betyr at selv hybridorbitaler ikke egentlig er degenererte. Derfor kan degenererte orbitaler som konklusjon bare eksistere i isolerte atomer eller i svært symmetriske miljøer..
Referanser
- Chemicool Dictionary. (2017). Definisjon av Degenerate. Gjenopprettet fra: chemicool.com
- SparkNotes LLC. (2018). Atomer og Atomic Orbitals. Gjenopprettet fra: sparknotes.com
- Ren kjemi. (s.f.). Elektronisk konfigurasjon. Gjenopprettet fra: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Moreno R. Esparza. (2009). Kurs for koordineringskjemi: Felt og orbitaler. [PDF]. Gjenopprettet fra: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.


Ingen har kommentert denne artikkelen ennå.