
Atomradius hvordan den måles, hvordan den endres og eksempler
De atomradio det er en viktig parameter for de periodiske egenskapene til elementene i det periodiske systemet. Det er direkte relatert til størrelsen på atomene, siden jo større radius, jo større eller mer voluminøs er de. På samme måte er det relatert til deres elektroniske egenskaper..
Jo flere elektroner et atom har, desto større er atomstørrelsen og radiusen. Begge er definert av elektronene til valensskallet, fordi i avstander utenfor banene nærmer seg sannsynligheten for å finne et elektron null. Det motsatte skjer i nærheten av kjernen: sannsynligheten for å finne et elektron øker.

Det øvre bildet representerer en pakning med bomullsballer. Merk at hver og en er omgitt av seks naboer, uten å telle en annen mulig øvre eller nedre rad. Måten bomullsbollene komprimeres på vil definere størrelser og derfor radiene; akkurat som atomer.
Elementene i henhold til deres kjemiske natur samhandler med sine egne atomer på en eller annen måte. Følgelig varierer størrelsen på atomradiusen avhengig av hvilken type binding som er tilstede og den faste pakningen av atomene..
Artikkelindeks
- 1 Hvordan måles atomradiusen?
- 1.1 Bestemmelse av internukleær avstand
- 1.2 Enheter
- 2 Hvordan endrer det seg i det periodiske systemet?
- 2.1 Over en periode
- 2.2 Nedstigning gjennom en gruppe
- 2.3 Lantanidkontraksjon
- 3 eksempler
- 4 Referanser
Hvordan måler du atomradiusen?
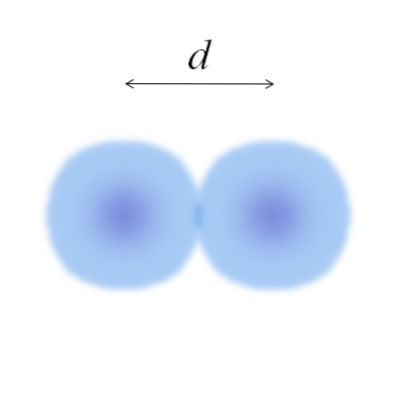
I hovedbildet kan det være enkelt å måle diameteren på bomullsbollene, og deretter dele den med to. Sfæren til et atom er imidlertid ikke fullstendig definert. Hvorfor? Fordi elektroner sirkulerer og diffunderer i spesifikke områder av rommet: orbitaler.
Derfor kan atomet betraktes som en kule med uimplerbare kanter, som det er umulig å si sikkert hvor langt de ender. For eksempel, i bildet over, viser senterregionen, nær kjernen, en mer intens farge mens kantene er uskarpe..
Bildet representerer et diatomisk molekyl E.to (som Clto, Hto, ELLERto, etc.). Forutsatt at atomene er sfæriske legemer, hvis avstanden ble bestemt d som skiller begge kjernene i den kovalente bindingen, vil det være tilstrekkelig å dele den i to halvdeler (d/ 2) for å oppnå atomradiusen; mer presist, den kovalente radien fra E til Eto.
Hva om E ikke dannet kovalente bindinger med seg selv, men var et metallisk element? Deretter d det ville være indikert av antall naboer som omgir E i metallstrukturen; det vil si ved koordinasjonsnummeret (N.C) for atomet inne i emballasjen (husk bomullsbollene i hovedbildet).
Bestemmelse av den internukleare avstanden
Å bestemme d, som er den kjernefysiske avstanden for to atomer i et molekyl eller en emballasje, kreves fysiske analyseteknikker.
En av de mest brukte er røntgendiffraksjon. I den blir en lysstråle bestrålet gjennom en krystall, og diffraksjonsmønsteret som følge av samspillet mellom elektroner og elektromagnetisk stråling studeres. Avhengig av pakking, kan forskjellige diffraksjonsmønstre oppnås og derfor andre verdier av d.
Hvis atomene er "stramme" i krystallgitteret, vil de presentere forskjellige verdier av d sammenlignet med hva de ville hatt hvis de var "komfortable". På samme måte kan disse internukleære avstandene svinge i verdier, slik at atomradius faktisk består av en gjennomsnittsverdi av slike målinger..
Hvordan er atomradiusen og koordinasjonsnummeret relatert? V. Goldschmidt etablerte et forhold mellom de to, der den relative verdien for en N.C på 12 er 1; 0,97 for en pakning der atomet har N.C lik 8; 0,96, for en N.C lik 6; og 0,88 for en N.C på 4.
Enheter
Fra verdiene for N.C lik 12, har mange av tabellene blitt konstruert der atomradiene til alle elementene i det periodiske systemet sammenlignes.
Ettersom ikke alle elementene danner slike kompakte strukturer (N.C mindre enn 12), brukes V. Goldschmidt-forholdet til å beregne atomradiene og uttrykke dem for samme pakking. På denne måten er målingene av atomradiene standardisert..
Men i hvilke enheter kommer de til uttrykk? Gitt d er av veldig liten størrelse, må vi ty til angstromsenhetene Å (10 ∙ 10-10m) eller også mye brukt, pikometeret (10 ∙ 10-12m).
Hvordan endrer det seg i det periodiske systemet?
Over en periode
Atomeradiene som er bestemt for metalliske elementer kalles metalliske radier, mens for ikke-metalliske elementer er kovalente radier (som fosfor, P4, eller svovel, S8). Imidlertid er det et mer fremtredende skille mellom navnet på de to eiketypene.
Fra venstre til høyre i samme periode, tilfører kjernen protoner og elektroner, men sistnevnte er begrenset til samme energinivå (hovedkvantetall). Som en konsekvens utøver kjernen en økende effektiv kjernefysisk ladning på valenselektronene, som trekker sammen atomradiusen..
På denne måten har ikke-metalliske elementer i samme periode en tendens til å ha mindre atomare (kovalente) radier enn metaller (metalliske radier).
Fallende gjennom en gruppe
Når du kommer ned gjennom en gruppe, aktiveres nye energinivåer, som gjør at elektronene får mer plass. Dermed dekker den elektroniske skyen større avstander, den uskarpe periferien ender med å bevege seg lenger vekk fra kjernen, og derfor utvides atomradiusen..
Lantanid sammentrekning
Elektronene i det indre skallet hjelper til med å skjerme den effektive kjernefysiske ladningen på valenselektronene. Når orbitalene som utgjør de indre lagene har mange ”hull” (noder), slik det skjer med f-orbitalene, trekker kjernen seg sterkt til atomradien på grunn av deres dårlige skjermingseffekt..
Dette faktum fremgår av sammentrekningen av lantanid i periode 6 i det periodiske systemet. Fra La til Hf er det en betydelig sammentrekning av atomradiusen som et resultat av f-orbitalene, som "fylles opp" når f-blokken krysses: den av lanthanoider og actinoider.
En lignende effekt kan også observeres med elementene i blokk p fra periode 4. Denne gangen, produkt av den svake skjermingseffekten av d-orbitalene som fylles når de passerer overgangsmetallperioder.
Eksempler
For periode 2 i det periodiske systemet er atomradiene til elementene:
-Li: 257 pm
-Vær: 112 pm
-B: 88 pm
-Kl. 77.00
-N: 74 pm
-Eller: kl
-F: 64 pm
Merk at litiummetall har den største atomradiusen (257 pm), mens fluor, som ligger helt til høyre i perioden, er den minste av dem alle (64 pm). Atomradien senker seg fra venstre til høyre i samme periode, og de oppførte verdiene viser den.
Når litium dannes metallbindinger, er radiusen metallisk; og fluor, da det danner kovalente bindinger (F-F), er radiusen kovalent.
Hva om du vil uttrykke atomradiene i enheter av angstrom? Bare del dem med 100: (257/100) = 2,57Å. Og så videre med resten av verdiene.
Referanser
- Kjemi 301. Atomic Radii. Gjenopprettet fra: ch301.cm.utexas.edu
- CK-12 Foundation. (28. juni 2016). Atomic Radius. Gjenopprettet fra: chem.libretexts.org
- Trender i Atomic Radii. Hentet fra: intro.chem.okstate.edu
- Clackamas Community College. (2002). Atomisk størrelse. Gjenopprettet fra: dl.clackamas.edu
- Clark J. (august 2012). Atomisk og ionisk radius. Gjenopprettet fra: chemguide.co.uk
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave., S. 23, 24, 80, 169). Mc Graw Hill.



Ingen har kommentert denne artikkelen ennå.