
Endotermiske reaksjonsegenskaper, ligninger og eksempler

EN endoterm reaksjon Det er en som skal skje, må absorbere energi, i form av varme eller stråling, fra omgivelsene. Generelt, men ikke alltid, kan de gjenkjennes av et temperaturfall i omgivelsene; eller tvert imot, de trenger en varmekilde, slik som den som oppnås ved en brennende flamme.
Absorpsjonen av energi eller varme er det alle endotermiske reaksjoner har til felles; deres natur, så vel som transformasjonene som er involvert, er veldig forskjellige. Hvor mye varme skal de absorbere? Svaret avhenger av dens termodynamikk: temperaturen der reaksjonen skjer spontant.

For eksempel er en av de mest emblematiske endotermiske reaksjonene endring av tilstand fra is til flytende vann. Is må absorbere varme til temperaturen når omtrent 0 ° C; ved den temperaturen blir smeltingen spontan, og isen vil absorbere til den har smeltet helt.
I varme rom, som ved bredden av en strand, er temperaturene høyere og derfor absorberer isen varmen raskere; det vil si at den smelter raskere. Smelting av isbreer er et eksempel på en uønsket endoterm reaksjon.
Hvorfor skjer det på denne måten? Hvorfor kan ikke is fremstå som et varmt fast stoff? Svaret ligger i den gjennomsnittlige kinetiske energien til vannmolekylene i begge tilstander, og hvordan de samhandler med hverandre gjennom hydrogenbindinger..
I flytende vann har molekylene større bevegelsesfrihet enn i is, der de vibrerer stasjonært i krystallene. For å bevege seg, må molekyler absorbere energi på en slik måte at deres vibrasjoner bryter de sterke retningsbestemte hydrogenbindinger i isen..
Av denne grunn absorberer is varme for å smelte. For at "varm is" skal eksistere, må hydrogenbindinger være unormalt sterke for å smelte ved en temperatur godt over 0 ° C..
Artikkelindeks
- 1 Kjennetegn ved en endoterm reaksjon
- 1.1 ΔH> 0
- 1.2 De kjøler omgivelsene
- 2 ligninger
- 3 eksempler på vanlige endotermiske reaksjoner
- 3.1 Fordamping av tørris
- 3.2 Bake brød eller lage mat
- 3.3 Soling
- 3.4 Reaksjon av atmosfærisk nitrogen- og ozondannelse
- 3.5 Elektrolyse av vann
- 3.6 Fotosyntese
- 3.7 Løsninger av noen salter
- 3.8 Termisk spaltning
- 3.9 Ammoniumklorid i vann
- 3.10 Natriumtriosulfat
- 3.11 Bilmotorer
- 3.12 Kokende væsker
- 3.13 Koke et egg
- 3.14 Matlaging
- 3.15 Oppvarming av mat i mikrobølgeovn
- 3.16 Glassstøping
- 3.17 Forbruk av et lys
- 3.18 Rengjøring av varmt vann
- 3.19 Varmesterilisering av mat og andre gjenstander
- 3.20 Bekjempelse av infeksjoner med feber
- 3.21 Vannfordampning
- 4 Referanser
Kjennetegn ved en endoterm reaksjon
Endring av tilstand er ikke riktig en kjemisk reaksjon; det samme skjer imidlertid: produktet (flytende vann) har høyere energi enn reaktanten (is). Dette er hovedkarakteristikken for en endoterm reaksjon eller prosess: produktene er mer energiske enn reaktantene.
Selv om dette er sant, betyr det ikke at produkter nødvendigvis må være ustabile. I tilfelle det er, er den endotermiske reaksjonen ikke lenger spontan under alle temperatur- eller trykkforhold..
Vurder følgende kjemiske ligning:
A + Q => B
Der Q representerer varme, vanligvis uttrykt i enhetene joule (J) eller kalorier (cal). Når A absorberer varme Q for å transformere til B, sies det at det er en endoterm reaksjon. Dermed har B mer energi enn A, og må absorbere nok energi til å oppnå transformasjonen.
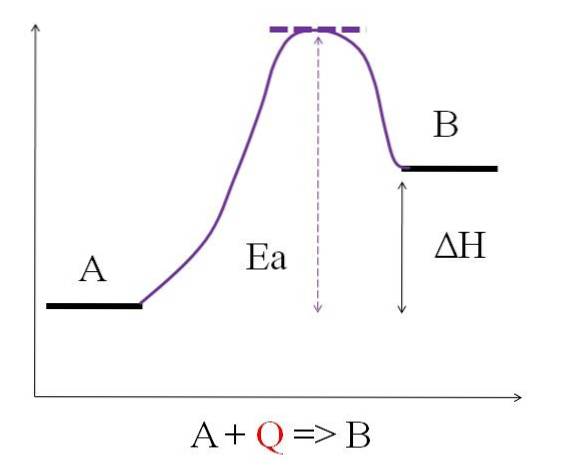
Som det kan sees i diagrammet ovenfor, har A mindre energi enn B. Mengden varme Q absorbert av A er slik at den overvinner aktiveringsenergien (energien som trengs for å nå den lilla toppen med det prikkede taket). Forskjellen i energi mellom A og B er kjent som reaksjonens entalpi, Ah.
ΔH> 0
Alle endotermiske reaksjoner har det ovennevnte diagrammet til felles, siden produktene er mer energiske enn reaktantene. Derfor er energiforskjellen mellom dem, ΔH, alltid positiv (HProdukt-HReagens > 0). Da dette er sant, må det være en absorpsjon av varme eller energi fra omgivelsene for å tilføre dette energibehovet..
Og hvordan tolkes slike uttrykk? I en kjemisk reaksjon brytes alltid bindinger for å skape nye. For å bryte dem, er absorpsjon av energi nødvendig; det vil si at det er et endotermisk trinn. I mellomtiden innebærer dannelsen av obligasjonene stabilitet, så det er et eksotermt trinn..
Når dannede bindinger ikke gir stabilitet som kan sammenlignes med mengden energi som kreves for å bryte de gamle bindingene, er det en endoterm reaksjon. Dette er grunnen til at det trengs ekstra energi for å fremme brudd på de mest stabile bindingene i reaktantene..
På den annen side oppstår det motsatte i eksoterme reaksjoner: varme frigjøres, og ΔH er < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
De kjøler omgivelsene
Selv om det ikke gjelder alle endotermiske reaksjoner, forårsaker flere av dem en reduksjon i temperaturen i omgivelsene. Dette er fordi den absorberte varmen kommer fra et sted. Følgelig, hvis omdannelsen av A og B ble utført inne i en container, ville den bli avkjølt.
Jo mer endoterm reaksjonen er, desto kaldere blir beholderen og omgivelsene. Faktisk er noen reaksjoner til og med i stand til å danne et tynt lag med is, som om de hadde kommet ut av et kjøleskap..
Imidlertid er det reaksjoner av denne typen som ikke kjøler omgivelsene. Hvorfor? Fordi varmen rundt er utilstrekkelig; det vil si at den ikke gir den nødvendige Q (J, cal) som er skrevet i kjemiske ligninger. Derfor er dette når brann eller ultrafiolett stråling kommer inn..
Det kan oppstå litt forvirring mellom de to scenariene. På den ene siden er varmen fra omgivelsene nok til at reaksjonen fortsetter spontant, og avkjøling observeres; og på den annen side er det behov for mer varme og en effektiv oppvarmingsmetode blir brukt. I begge tilfeller skjer det samme: energi absorberes.
Ligninger
Hva er de relevante ligningene i en endoterm reaksjon? Som allerede forklart, må ΔH være positiv. For å beregne det blir først den følgende kjemiske ligningen vurdert:
aA + bB => cC + dD
Der A og B er reaktantene, og C og D er produktene. Små bokstaver (a, b, c og d) er de støkiometriske koeffisientene. For å beregne ΔH for denne generiske reaksjonen, brukes følgende matematiske uttrykk:
ΔHProdukter- ΔHReagenser = ΔHrxn
Du kan fortsette direkte, eller gjøre beregningene separat. For ΔHProdukter følgende sum må beregnes:
c ΔHFC + d ΔHFD
Hvor ΔHF er entalpi av dannelsen av hvert stoff involvert i reaksjonen. Etter konvensjon har stoffer i deres mest stabile former ΔHF= 0. For eksempel molekyler av Oto og Hto, eller et solid metall, har ΔHF= 0.
Den samme beregningen gjøres nå for reaktantene, ΔHReagenser:
a ΔHFA + b ΔHFB
Men siden ligningen sier at ΔHReagenser må trekkes fra ΔHProdukter, så må summen multipliseres med -1. Så du har:
c ΔHFC + d ΔHFD - (a ΔHFA + b ΔHFB)
Hvis resultatet av denne beregningen er et positivt tall, er det en endoterm reaksjon. Og hvis det tester negativt, er det en eksoterm reaksjon.
Eksempler på vanlige endotermiske reaksjoner
Fordamping av tørris

Alle som noen gang har sett de hvite røykene som kommer fra en iskremvogn, har vært vitne til et av de vanligste eksemplene på en endoterm "reaksjon".
Utover noen iskrem har disse dampene som er avgitt fra hvite faste stoffer, kalt tørris, også vært en del av scenariene for å skape effekten av tåke. Denne tørrisen er ikke annet enn fast karbondioksid, som når den absorberer temperaturen og før det ytre trykket begynner å sublimere seg.
Et eksperiment for et barnepublikum ville være å fylle og forsegle en pose med tørris. Etter en stund vil den til slutt blåses opp på grunn av COto gassformet, som genererer arbeid eller presser de indre veggene på posen mot atmosfæretrykk.
Bake brød eller lage mat

Å bake brød er et eksempel på en kjemisk reaksjon, siden det nå er kjemiske endringer på grunn av varme. Alle som har luktet aromaen av nybakte brød, vet at en endoterm reaksjon skjer.
Deigen og alle dens ingredienser trenger ovnens varme for å utføre alle transformasjonene, som er essensielle for å bli brød og vise de typiske egenskapene..
I tillegg til brød er kjøkkenet fullt av eksempler på endotermiske reaksjoner. Den som lager mat, behandler dem daglig. Koke pasta, myke opp kjernene, varme opp maiskornene, koke egg, krydre kjøtt, bake en kake, lage te, varme opp smørbrød; hver av disse aktivitetene er endotermiske reaksjoner.
Soling

Så enkelt og vanlig som de kan virke, faller solbad tatt av visse reptiler, som skilpadder og krokodiller, inn i kategorien endotermiske reaksjoner. Skilpadder absorberer varme fra solen for å regulere kroppstemperaturen.
Uten solen beholder de varmen fra vannet for å holde varmen; som ender opp i avkjølingen av vannet i dammer eller akvarier.
Reaksjon av atmosfærisk nitrogen- og ozondannelse

Luft består hovedsakelig av nitrogen og oksygen. Under elektriske stormer frigjøres slik energi at den kan bryte de sterke bindingene som holder nitrogenatomene sammen i N-molekylet.to:
Nto + ELLERto + Q => 2NO
På den annen side kan oksygen absorbere ultrafiolett stråling for å bli ozon; allotrope av oksygen som er veldig gunstig i stratosfæren, men skadelig for livet på bakkenivå. Reaksjonen er:
3Oto + v => 2O3
Hvor v betyr ultrafiolett stråling. Mekanismen bak den enkle ligningen er veldig kompleks.
Elektrolyse av vann
Elektrolyse bruker elektrisk energi for å skille et molekyl i dets dannende elementer eller molekyler. For eksempel genereres to gasser ved elektrolyse av vann: hydrogen og oksygen, hver i forskjellige elektroder:
2HtoO => 2Hto + ELLERto
Også natriumklorid kan gjennomgå samme reaksjon:
2NaCl => 2Na + Clto
I den ene elektroden vil du se dannelsen av metallisk natrium, og i den andre grønne klorbobler.
Fotosyntese

Planter og trær trenger å absorbere sollys som en energiforsyning for å syntetisere sine biomaterialer. Til dette bruker den CO som råstoff.to og vann, som gjennom en lang rekke trinn omdannes til glukose og annet sukker. I tillegg dannes oksygen som frigjøres fra bladene.
Løsninger av noen salter
Hvis natriumklorid er oppløst i vann, vil det ikke være noen merkbar endring i glassets eller beholderens utetemperatur..
Noen salter, slik som kalsiumklorid, CaClto, øke vannetemperaturen som et produkt av den store hydrering av Ca-ionerto+. Og andre salter, som ammoniumnitrat eller klorid, NH4IKKE3 og NH4Cl, senk vanntemperaturen og avkjøl omgivelsene.
I klasserom gjøres hjemmeeksperimenter vanligvis ved å oppløse noen av disse saltene for å demonstrere hva en endoterm reaksjon er..
Temperaturfallet skyldes hydrering av NH-ionene4+ det er ikke begunstiget mot oppløsningen av de krystallinske arrangementene av saltene. Følgelig absorberer saltene varme fra vannet for å tillate ionene å bli solvatisert..
En annen kjemisk reaksjon som vanligvis er veldig vanlig for å demonstrere dette, er følgende:
Ba (OH)to8HtoO + 2NH4IKKE3 => Ba (NO3)to + 2NH3 +10HtoELLER
Legg merke til mengden vann som dannes. Ved å blande begge faste stoffer, en vandig løsning av Ba (NO3)to, lukt av ammoniakk, og med en temperaturfall slik at den bokstavelig talt fryser den ytre overflaten av beholderen.
Termisk spaltning
En av de vanligste termiske nedbrytningene er natriumbikarbonat, NaHCO3, å produsere COto og vann ved oppvarming. Mange faste stoffer, inkludert karbonater, brytes ofte ned for å frigjøre COto og tilsvarende oksyd. For eksempel er nedbrytningen av kalsiumkarbonat som følger:
Tyv3 + Q => CaO + COto
Det samme skjer med magnesium, strontium og bariumkarbonater.
Det er viktig å merke seg at termisk nedbrytning er forskjellig fra forbrenning. I den første er det ingen nærvær av antennelse eller varme frigjøres, mens i den andre er det; forbrenning er en eksoterm reaksjon, selv når den trenger en innledende varmekilde for å finne sted eller oppstå spontant.
Ammoniumklorid i vann
Når en liten mengde ammoniumklorid (NH4Cl) oppløses i vann i et prøverør, blir røret kaldere enn før. Under denne kjemiske reaksjonen absorberes varme fra miljøet.
Natriumtriosulfat
Når krystaller av natriumtiosulfat (NatoStoELLER3.5HtoO), ofte kalt hikke, oppløses i vann, kjøleeffekt oppstår.
Bilmotorer
Brenning av bensin eller diesel i motorene til biler, lastebiler, traktorer eller busser gir mekanisk energi som brukes i sirkulasjonen av disse kjøretøyene..
Kokende væsker
Ved å sette en væske på varme, får den energi og går i gassform.
Kok et egg
Når det påføres varme, denatureres eggproteinene og danner den faste strukturen som vanligvis inntas..
Lage mat
Generelt forekommer det endotermiske reaksjoner når du lager mat med varme for å endre egenskapene til maten.
Disse reaksjonene får maten til å bli mykere, genererer smidige masser, frigjør blant annet komponentene de inneholder..
Oppvarming av mat i mikrobølgeovn
Ved mikrobølgestråling absorberer vannmolekyler i mat energi, begynner å vibrere og øker temperaturen på maten.
Glassstøping
Opptaket av varme gjennom glasset gjør skjøtene fleksible, noe som gjør formen lettere å endre.
Forbruk av et lys
Stearinvoks smelter ved å absorbere varmen fra flammen og endre form.
Rengjøring av varmt vann
Når du bruker varmt vann til å rengjøre gjenstander som er farget med fett, for eksempel gryter eller klær, blir fettet mer flytende og lettere å fjerne.
Varmesterilisering av mat og andre gjenstander
Ved oppvarming av gjenstander eller mat øker også mikroorganismene de inneholder.
Når det tilføres mye varme, oppstår reaksjoner i mikrobielle celler. Mange av disse reaksjonene, som bryting av bindinger eller denaturering av proteiner, ender med å drepe mikroorganismer.
Bekjemp infeksjoner med feber
Når feber oppstår, er det fordi kroppen produserer den nødvendige varmen for å drepe bakteriene og virusene som forårsaker infeksjoner og genererer sykdommer..
Hvis varmen som genereres er mye og feberen er høy, påvirkes også kroppens celler og det er fare for død.
Vannfordampning
Når vann fordamper og blir til damp, skyldes det varmen det mottar fra omgivelsene. Når varmeenergi mottas av hvert vannmolekyl, øker vibrasjonsenergien til det punktet hvor den kan bevege seg fritt og skape damp..
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2018). Endoterm prosess. Gjenopprettet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27. desember 2018). Endotermiske reaksjonseksempler. Gjenopprettet fra: thoughtco.com
- Khan Academy. (2019). Endotermisk vs. eksoterme reaksjoner. Gjenopprettet fra: khanacademy.org
- Serm Murmson. (2019). Hva skjer på molekylært nivå under en endoterm reaksjon? Hearst Seattle Media. Gjenopprettet fra: education.seattlepi.com
- QuimiTube. (2013). Beregning av reaksjonshalpien fra dannelsesens entalpier. Gjenopprettet fra: quimitube.com
- Quimicas.net (2018). Eksempler på endoterm reaksjon. Kommet seg fra:
chemistry.net.

Ingen har kommentert denne artikkelen ennå.