
Karakteristiske kjemiske reaksjoner, deler, typer, eksempler

De kjemiske reaksjoner De er endringer som betyr noe i arrangementet av atomene, og de finner sted når to forskjellige stoffer eller forbindelser kommer i kontakt. Endringer kommer fra prosessen som kan sees umiddelbart; slik som en økning i temperatur, avkjøling, gassdannelse, blinking eller utfelling av et fast stoff.
De vanligste kjemiske reaksjonene går ofte upåaktet hen i hverdagen; tusenvis av dem blir utført i kroppene våre. Andre er imidlertid mer synlige, siden vi kan lage dem på kjøkkenet ved å velge riktig redskap og ingredienser; for eksempel å blande natron med eddik, smelte sukker i vann eller surgjøre lilla kåljuice.

På laboratorier blir kjemiske reaksjoner vanligere og vanlige; alt forekommer i begerglass eller Erlenmeyer-kolber. Hvis de deler noe til felles, er det at ingen av dem er enkle, siden de skjuler kollisjoner, koblingsbrudd, mekanismer, lenkeformasjon, energi og kinetiske aspekter..
Det er kjemiske reaksjoner så slående at amatører og forskere, som kjenner toksikologien til reagenser og noen sikkerhetstiltak, gjengir dem i store skalaer i fascinerende demonstrasjonshendelser..
Artikkelindeks
- 1 Begrepet kjemisk reaksjon
- 2 Kjennetegn på kjemiske reaksjoner
- 2.1 Kinetikk
- 2.2 Konservering av deig
- 2.3 Fysiske endringer og / eller tilstandsendringer
- 2.4 Fargevariasjon
- 2.5 Utslipp av gasser
- 2.6 Temperaturendringer
- 3 Deler av en kjemisk reaksjon
- 3.1 Reagenser og produkter
- 3.2 Reaksjonsmedier
- 3.3 Fartøy eller reaktorer
- 4 Typer kjemiske reaksjoner
- 4.1 - Oksidasjonsreduksjon (redoks)
- 4.2 - Syntese
- 4.3 - Nedbrytning
- 4.4 - Forskyvning
- 4.5 - Gassdannelse
- 4.6 - Metatese eller dobbel forskyvning
- 5 Eksempler på kjemiske reaksjoner
- 5.1 Rulle
- 5.2 Nøytralisering
- 5.3 Dobbel rulling
- 5.4 Redoks
- 6 Løst kjemiske reaksjoner øvelser
- 6.1 - Øvelse 1
- 6.2 - Øvelse 2
- 6.3 - Øvelse 3
- 7 Referanser
Kjemisk reaksjonskonsept
Kjemiske reaksjoner finner sted når det brytes en binding (ionisk eller kovalent), slik at en annen blir dannet i stedet; to atomer eller et sett av dem slutter å samhandle sterkt for å opprette nye molekyler. Takket være dette kan de kjemiske egenskapene til en forbindelse, dens reaktivitet, stabilitet, med det den reagerer bestemmes.
I tillegg til å være ansvarlig for de kjemiske reaksjonene som materien transformerer hele tiden, uten å påvirke atomene, forklarer de fremveksten av forbindelser slik vi kjenner dem..
Energi er nødvendig for at obligasjoner skal bryte, og når obligasjoner dannes frigjøres det. Hvis den absorberte energien er større enn den som frigjøres, sies reaksjonen å være endoterm; vi avkjøler omgivelsene. Mens den frigitte varmen er høyere enn den absorberte, vil det være en eksoterm reaksjon. omgivelsene blir varme.
Kjennetegn ved kjemiske reaksjoner

Kinetikk
Molekylene må i teorien kollidere med hverandre og bære med seg nok kinetisk energi til å fremme brudd på en binding. Hvis kollisjonene deres er langsomme eller ineffektive, påvirkes den kjemiske reaksjonen kinetisk. Dette kan skje enten av stoffenes fysiske tilstander, eller av deres geometri eller struktur..
Således transformeres materie ved en reaksjon ved å absorbere eller frigjøre varme, samtidig som den gjennomgår kollisjoner som favoriserer dannelsen av produkter; de viktigste komponentene i enhver kjemisk reaksjon.
Konservering av deig
På grunn av loven om bevaring av masse forblir den totale massen av forsamlingen konstant etter en kjemisk reaksjon. Dermed er summen av de enkelte massene til hvert stoff lik massen av resultatet oppnådd.
Fysiske endringer og / eller tilstandsendringer
Forekomsten av en kjemisk reaksjon kan ledsages av en endring i tilstanden til komponentene; det vil si en variasjon i den faste, flytende eller gassformige tilstanden til materialet.
Imidlertid involverer ikke alle tilstandsendringer en kjemisk reaksjon. For eksempel: Hvis vann fordamper på grunn av effekten av varme, er vanndampen som produseres etter denne tilstandsendringen fortsatt vann.
Fargevariasjon
Blant de fysiske egenskapene som skyldes en kjemisk reaksjon, skiller endringen i fargen på reagensene i forhold til fargen på sluttproduktet seg ut..
Dette fenomenet er merkbart når man observerer den kjemiske reaksjonen av metaller med oksygen: når et metall oksiderer, endrer det sin karakteristiske farge (gull eller sølv, alt etter omstendighetene), for å gjøre en rød-oransje fargetone, kjent som rust..
Utslipp av gasser
Denne egenskapen manifesteres som en boblende eller med utslipp av spesielle lukt.
Generelt vises bobler som en konsekvens av at væske utsettes for høye temperaturer, noe som oppmuntrer til en økning i kinetisk energi til molekylene som er en del av reaksjonen..
Temperaturendringer
I tilfelle varme er en katalysator for den kjemiske reaksjonen, vil en endring i temperatur induseres i sluttproduktet. Derfor kan inn- og utgang av varme i prosessen også være et kjennetegn ved kjemiske reaksjoner..
Deler av en kjemisk reaksjon
Reagenser og produkter
Enhver kjemisk reaksjon er representert av en ligning av typen:
A + B → C + D
Der A og B er reaktantene, mens C og D er produktene. Ligningen forteller oss at atomet eller molekylet A reagerer med B på opprinnelige produkter C og D. Dette er en irreversibel reaksjon, siden reaktantene ikke kan stamme fra produktene igjen. På den annen side er reaksjonen nedenfor reversibel:
A + B. <=> C + D
Det er viktig å understreke at massen til reaktantene (A + B) må være lik massen til produktene (C + D). Ellers ville ikke deigen konserveres. Tilsvarende må antall atomer for et gitt element være det samme før og etter pilen.
Over pilen er noen spesifikke spesifikasjoner for reaksjonen indikert: temperatur (Δ), forekomst av ultrafiolett stråling (hv), eller brukt katalysator.
Reaksjonsmedier
Når det gjelder liv og reaksjonene som oppstår i kroppene våre, er reaksjonsmediet vandig (ac). Imidlertid kan kjemiske reaksjoner finne sted i hvilket som helst flytende medium (etanol, iseddik, toluen, tetrahydrofuran, etc.) så lenge reagensene er godt oppløst..
Fartøy eller reaktorer
Kontrollerte kjemiske reaksjoner forekommer i et kar, enten et enkelt glass eller i en reaktor av rustfritt stål.
Typer kjemiske reaksjoner
Typer av kjemiske reaksjoner er basert på hva som skjer på molekylært nivå; hvilke bånd som brytes og hvordan atomer ender med å bli sammen. På samme måte tas det i betraktning om arten vinner eller mister elektroner; selv om dette forekommer i de fleste kjemiske reaksjoner.
Her forklarer vi de forskjellige typene kjemiske reaksjoner som eksisterer.
- Oksidasjonsreduksjon (redoks)
Kobberoksidasjon
I eksemplet med patina finner en oksidasjonsreaksjon sted: metallisk kobber mister elektroner i nærvær av oksygen for å transformere til det tilsvarende oksid.
4Cu (s) + Oto(g) => CutoDu)
Kobber (I) oksyd fortsetter å oksidere til kobber (II) oksid:
2CutoO (s) + Oto => 4CuO (s)
Denne typen kjemisk reaksjon der arten øker eller reduserer antall (eller tilstander) oksidasjon, er kjent som oksidasjons- og reduksjonsreaksjon..
Metallisk kobber med oksidasjonstilstand 0, mister først ett elektron, og deretter det andre (oksyderer), mens oksygen forblir (reduserer):
Cu => Cu+ + og-
Cu+ => Cuto+ + og-
ELLERto + 2e- => 2Oto-
Gevinsten eller tapet av elektroner kan bestemmes ved å beregne oksidasjonstallene for atomene i de kjemiske formlene til deres resulterende forbindelser..
For CutoEller det er kjent at vi har anionet O fordi det er et oksidto-, Derfor, for å holde ladningene nøytraliserte, må hvert av de to kobberatomene ha en ladning på +1. Svært likt skjer med CuO.
Når kobber oksiderer, får det positive oksidasjonstall; og oksygen, som skal reduseres, negative oksidasjonsnumre.
Jern og kobolt
Ytterligere eksempler på redoksreaksjoner er vist nedenfor. Det vil også bli gitt en kort kommentar og endringene i oksidasjonsnumrene vil bli spesifisert..
FeClto + CoCl3 => FeCl3 + CoClto
Hvis oksidasjonstallene beregnes, vil det bemerkes at de av Cl forblir med en konstant verdi på -1; ikke slik, med de fra Fe y Co..
Ved første øyekast har jern blitt oksidert mens kobolt har blitt redusert. Hvordan vet du? Fordi jern nå samhandler ikke med to Cl-anioner- men med tre, er kloratomet (nøytralt) mer elektronegativt enn jern og kobolt. På den annen side skjer det motsatte med kobolt: det går fra å samhandle med tre Cl- to av dem.
Hvis resonnementet ovenfor ikke er klart, fortsetter vi å skrive de kjemiske ligningene til nettoverføringen av elektroner:
Troto+ => Tro3+ + og-
Co3+ + og- => Coto+
Derfor har Feto+ ruster, mens Co3+ er redusert.
Jod og mangan
6KMnO4 + 5KI + 18HCl => 6MnClto + 5KIO3 + 6KCl + 9HtoELLER
Den kjemiske ligningen ovenfor kan virke komplisert, men det er den ikke. Klor (Cl-) eller oksygen (Oto-) opplever gevinst eller tap av elektronene sine. Jod og mangan, ja.
Med tanke på bare forbindelsene med jod og mangan, har vi:
KI => KIO3 (oksidasjonsnummer: -1 til +5, mister seks elektroner)
KMnO4 => MnClto (oksidasjonsnummer: +7 til +2, få fem elektroner)
Jod oksideres, mens mangan reduseres. Hvordan vite uten å gjøre beregninger? Fordi jod går fra å være med kalium til å samhandle med tre oksygener (mer elektronegative); og mangan på sin side mister interaksjoner med oksygen for å være med klor (mindre elektronegativ).
KI kan ikke miste seks elektroner hvis KMnO4 vinne fem; det er derfor antall elektroner må balanseres i ligningen:
5 (KI => KIO3 + 6e-)
6 (KMnO4 + 5e- => MnClto)
Hvilket resulterer i en nettoverføring på 30 elektroner.
Forbrenning
Forbrenning er en kraftig og energisk oksidasjon der lys og varme frigjøres. Generelt deltar oksygen i denne typen kjemisk reaksjon som et oksidasjons- eller oksidasjonsmiddel; mens reduksjonsmiddelet er drivstoffet som brenner på slutten av dagen.
Der det er aske, var det forbrenning. Disse er i det vesentlige sammensatt av karbon og metalloksider; selv om sammensetningen logisk avhenger av hva drivstoffet var. Nedenfor er noen eksempler:
C (s) + Oto(g) => COto(g)
2CO (g) + Oto(g) => 2COto(g)
C3H8(g) + 5Oto(g) => 3COto(g) + 4HtoO (g)
Hver av disse ligningene tilsvarer fullstendig forbrenning; det vil si at alt drivstoff reagerer med et overskudd av oksygen for å garantere fullstendig transformasjon.
Det skal også bemerkes at COto og HtoEller er hovedproduktene gassformede når karbonholdige legemer brenner (som tre, hydrokarboner og dyrevev). Det er uunngåelig at det dannes noe karbonallotrop på grunn av utilstrekkelig oksygen, samt mindre oksygenerte gasser som CO og NO.
- Syntese
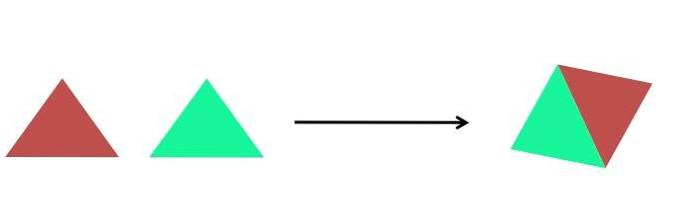
Bildet over viser en ekstremt enkel fremstilling. Hver trekant er en forbindelse eller et atom som sammenføyes for å danne en enkelt forbindelse; to trekanter danner et parallellogram. Massene øker, og de fysiske og kjemiske egenskapene til produktet er mange ganger veldig forskjellige fra reagensene.
For eksempel produserer forbrenningen av hydrogen (som også er en redoksreaksjon) hydrogenoksid eller oksygenhydrid; bedre kjent som vann:
Hto(g) + Oto(g) => 2HtoO (g)
Når de to gassene blandes, ved høy temperatur, brenner de og produserer gassformig vann. Etter hvert som temperaturen avkjøles, kondenserer dampene for å gi flytende vann. Flere forfattere anser denne syntesereaksjonen som et av de mulige alternativene for å erstatte fossilt brensel for å skaffe energi.
H-H og O = O bindinger brytes for å danne to nye enkeltbindinger: H-O-H. Vann er som kjent et unikt stoff (utenfor romantisk forstand), og dets egenskaper er ganske forskjellige fra gassformig hydrogen og oksygen..
Joniske forbindelser
Dannelsen av ioniske forbindelser fra elementene deres er også et eksempel på en syntesereaksjon. En av de enkleste er dannelsen av metallhalogenider i gruppe 1 og 2. For eksempel syntese av kalsiumbromid:
Ca (s) + Brto(l) => CaBrto(s)
En generell ligning for denne typen syntese er:
M (s) + Xto => MXto(s)
Koordinasjon
Når den dannede forbindelsen involverer et metallatom i en elektronisk geometri, sies det at det er et kompleks. I komplekser forblir metaller bundet til ligander ved svake kovalente bindinger, og dannes av koordineringsreaksjoner.
For eksempel har vi komplekset [Cr (NH3)6]3+. Dette dannes når kationen Cr3+ er i nærvær av ammoniakkmolekylene, NH3, som fungerer som kromligander:
Cr3+ + 6NH3 => [Cr (NH3)6]3+
Den resulterende koordineringsoktaedronen rundt krommetallsenteret er vist nedenfor:
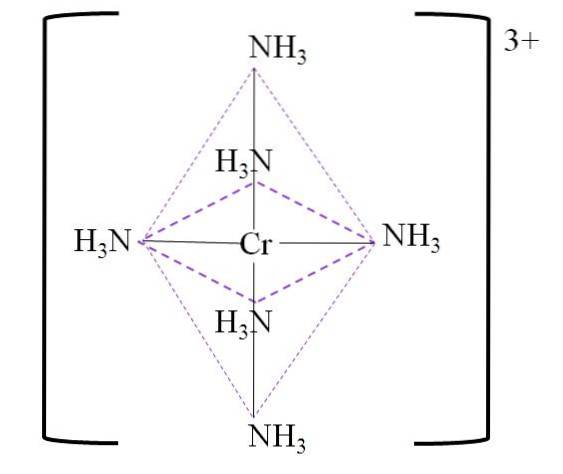
Merk at 3+ ladningen på krom ikke nøytraliseres i komplekset. Fargen er lilla, og det er derfor oktaederet er representert med den fargen.
Noen komplekser er mer interessante, som i tilfelle visse enzymer som koordinerer jern-, sink- og kalsiumatomer.
- Nedbrytning
Nedbrytning er det motsatte av syntese: en forbindelse nedbrytes i ett, to eller tre grunnstoffer eller forbindelser.
For eksempel har vi følgende tre nedbrytninger:
2HgO (s) => 2Hg (l) + Oto(g)
2HtoELLERto(l) => 2HtoO (l) + Oto(g)
HtoCO3(ac) => COto(g) + HtoO (l)
HgO er et rødlig fast stoff som, under påvirkning av varme, brytes ned i metallisk kvikksølv, en svart væske og oksygen..
Hydrogenperoksid eller hydrogenperoksid gjennomgår nedbrytning og gir flytende vann og oksygen.
Og karbonsyre nedbrytes på sin side til karbondioksid og flytende vann.
En "tørrere" nedbrytning er den som lider av metalliske karbonater:
Tyv3(s) => CaO (s) + COto(g)
Klassevulkan

En nedbrytningsreaksjon som har blitt brukt i kjemiklasser er den termiske nedbrytningen av ammoniumdikromat, (NH4)toCrtoELLER7. Dette kreftfremkallende appelsinsaltet (så det må håndteres med stor forsiktighet), brenner for å frigjøre mye varme og produsere et grønt fast, kromoksid, CrtoELLER3:
(NH4)toCrtoELLER7(s) => CrtoELLER3(s) + 4HtoO (g) + Nto(g)
- Forskyvning
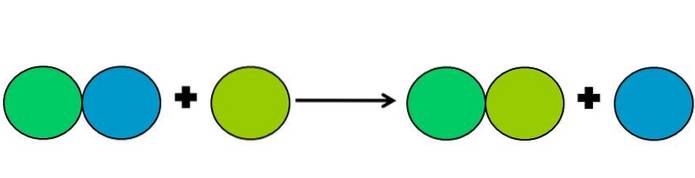
Forskyvningsreaksjoner er en type redoksreaksjon der et element fortrenger et annet i en forbindelse. Det fordrevne elementet ender med å redusere eller få elektroner.
For å forenkle ovenstående vises bildet ovenfor. Sirklene representerer et element. Det observeres at den limegrønne sirkelen forskyver den blå, og forblir på utsiden; men ikke bare det, men den blå sirkelen krymper i prosessen, og den limegrønne ruster.
Av hydrogen
For eksempel har vi de følgende kjemiske ligningene for å avsløre forklaringen ovenfor:
2Al (s) + 6HCl (aq) => AlCl3(aq) + 3Hto(g)
Zr (s) + 2HtoO (g) => ZrOto(s) + 2Hto(g)
Zn (s) + HtoSW4(ac) => ZnSO4(ac) + Hto(g)
Hva er det fortrengte elementet for disse tre kjemiske reaksjonene? Hydrogen, som er redusert til molekylært hydrogen, Hto; det går fra et oksidasjonsnummer på +1 til 0. Merk at metallene aluminium, zirkonium og sink kan fortrenge hydrogenene fra syrer og vann; mens kobber, verken sølv eller gull, ikke kan.
Av metaller og halogener
På samme måte er det disse to ytterligere forskyvningsreaksjonene:
Zn (s) + CuSO4(ac) => Cu (s) + ZnSO4(ac)
Clto(g) + 2Nal (aq) => 2NaCl (aq) + Ito(s)
I den første reaksjonen fortrenger sink det mindre aktive kobbermetallet; sink oksyderes mens kobber reduseres.
I den andre reaksjonen, derimot, fortrenger klor, et element som er mer reaktivt enn jod, det sistnevnte i natriumsaltet. Her er det omvendt: det mest reaktive elementet reduseres ved å oksidere det fordrevne elementet; derfor reduseres klor ved oksiderende jod.
- Gassdannelse
I reaksjonene kunne man se at flere av dem genererte gasser, og derfor går de også inn i denne typen kjemisk reaksjon. Likeledes betraktes reaksjonene i forrige avsnitt, som av hydrogenforskyvning av et aktivt metall, gassdannelsesreaksjoner..
I tillegg til de som allerede er nevnt, frigjør for eksempel metallsulfider hydrogensulfid (som lukter råtne egg) når saltsyre tilsettes:
NatoS (s) + 2HCl (aq) => 2NaCl (aq) + HtoS (g)
- Metatese eller dobbel forskyvning
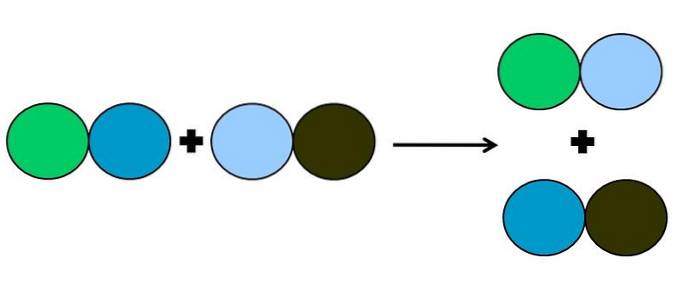
I metatesen eller dobbeltforskyvningsreaksjonen, skjer det en endring av partnere uten elektronoverføringer; det vil si at det ikke betraktes som en redoksreaksjon. Som det kan sees på bildet over, bryter den grønne sirkelen lenken med den mørkeblå sirkelen for å koble til den lyseblå sirkelen.
Nedbør
Når interaksjonen mellom en av partnerne er sterk nok til å overvinne væskens oppløsningseffekt, oppnås et bunnfall. Følgende kjemiske ligninger representerer nedbørsreaksjoner:
AgNO3(aq) + NaCl (aq) => AgCl (s) + NaNO3(ac)
CaClto(ac) + NatoCO3(ac) => CaCO3(s) + 2NaCl (aq)
I den første reaksjonen ble Cl- skifter til NO3- for å danne sølvklorid, AgCl, som er et hvitt bunnfall. Og i den andre reaksjonen, CO3to- skifter til Cl- å utfelle kalsiumkarbonat.
Basesyre
Kanskje den mest symbolske av metatesesreaksjonene er den av syre-basenøytralisering. Til slutt er to syre-base reaksjoner vist som eksempler:
HCl (aq) + NaOH (aq) => NaCl (aq) + HtoO (l)
2HCl (aq) + Ba (OH)to(ac) => BaClto(aq) + 2HtoO (l)
OH- fortreng Cl- for å danne vann og kloridsalter.
Eksempler på kjemiske reaksjoner
Nedenfor og under vil det bli nevnt noen kjemiske reaksjoner med deres respektive ligninger og kommentarer..
Forskyvning
Zn (s) + AgNO3(ac) → 2Ag (s) + Zn (NO3)to(ac)
Sink fortrenger sølv i nitratsaltet: reduserer det fra Ag+ til Ag. Som et resultat begynner metallisk sølv å falle ut i mediet, observert under mikroskopet som sølvfargede trær uten blader. På den annen side kombineres nitrat med Zn-ionerto+ som resulterer i dannelse av sinknitrat.
Nøytralisering
Tyv3(s) + 2HCl (aq) → CaClto(ac) + HtoO (l) + COto(g)
Saltsyre nøytraliserer kalsiumkarbonatsaltet for å produsere salt, kalsiumklorid, vann og karbondioksid. COto den bobler og blir oppdaget i vannet. Denne boblingen oppnås også ved å tilsette HCl til kritt eller eggeskall, rik på CaCO3.
NH3(g) + HCl (g) → NH4Cl (s)
I denne andre reaksjonen nøytraliserer HCl-dampene gassformig ammoniakk. Ammoniumkloridsaltet, NH4Cl, er dannet som en hvitaktig røyk (nedre bilde), da den inneholder veldig fine partikler suspendert i luften.

Dobbel bla
AgNO3(aq) + NaCl (aq) → AgCl (s) + NaNO3(ac)
I en dobbel fortrengningsreaksjon er det en utveksling av "partnere". Sølv bytter partner med natrium. Resultatet er at det nye saltet, sølvklorid, AgCl, utfelles som et melkeaktig fast stoff..
Redoks

Det er utallige redoksreaksjoner. En av de mest imponerende er Barkin Dogs:
8 NtoO (g) + 4 CSto(l) → S8(s) + 4 COto(g) + 8 Nto(g)
Energien som frigjøres når de tre stabile produktene dannes, er så mye at det er en blålig blits (øvre bilde) og en rungende økning i trykk forårsaket av gassene som stammer fra (COto og Nto).
Og i tillegg er alt dette ledsaget av en veldig høy lyd som ligner bjeffing av en hund. Det produserte svovelet, S8, belegg rørets innvendige vegger i gult.
Hvilken art er redusert og hvilken er oksidert? Som en generell regel har elementene oksidasjonsnummer 0. Derfor må svovel og nitrogen i produktene være arten som fikk eller mistet elektroner..
Svoveloksidert (tapte elektroner), da det hadde oksidasjonsnummer -2 i CSto (C4+Stoto-):
Sto- → S0 + 2e-
Mens nitrogen ble redusert (fått elektroner), fordi det hadde oksidasjonsnummer +1 i NtoO (Nto+ELLERto-):
2N+ + 2e → N0
Løst kjemiske reaksjoner øvelser
- Øvelse 1
Hvilket salt utfelles i den følgende reaksjon i vandig medium?
NatoS (ac) + FeSO4(ac) → ¿?
Generelt faller alle sulfider, med unntak av de dannet med alkalimetaller og ammonium, i vandig medium. En dobbel forskyvning skjer: jern binder til svovel og natrium til sulfat:
NatoS (ac) + FeSO4(ac) → FeS (s) + NatoSW4(ac)
- Øvelse 2
Hvilke produkter får vi fra følgende reaksjon?
Stemple3)to + Ca (OH)to →?
Kalsiumhydroksyd er ikke veldig løselig i vann; men tilsetning av kobbernitrat hjelper til med å oppløse det fordi det reagerer og danner dets tilsvarende hydroksid:
Stemple3)to(ac) + Ca (OH)to(ac) → Cu (OH)to(s) + Ca (NO3)to(ac)
Cu (OH)to umiddelbart gjenkjennelig som et blått bunnfall.
- Øvelse 3
Hvilket salt vil bli produsert i den følgende nøytraliseringsreaksjonen?
Al (OH)3(s) + 3HCl (aq) → ¿?
Aluminiumhydroksyd oppfører seg som en base som reagerer med saltsyre. I en syre-base nøytraliseringsreaksjon (Bronsted-Lowry) dannes det alltid vann, så det andre produktet må være aluminiumklorid, AlCl3:
Al (OH)3(s) + 3HCl (aq) → AlCl3(aq) + 3HtoELLER
Denne gangen har AlCl3 utfelles ikke fordi det er et salt (til en viss grad) løselig i vann.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Ana Zita. (18. november 2019). Kjemiske reaksjoner. Gjenopprettet fra: todamateria.com
- Kashyap Vyas. (23. januar 2018). 19 Kule kjemiske reaksjoner som viser at vitenskap er fascinerende. Gjenopprettet fra: interestingengineering.com
- BeautifulChemistry.net (s.f.). Reaksjon. Gjenopprettet fra: beautifulchemistry.net
- Wikipedia. (2019). Kjemisk reaksjon. Gjenopprettet fra: en.wikipedia.org


Ingen har kommentert denne artikkelen ennå.