
Rubidium historie, egenskaper, struktur, oppnåelse, bruk
De rubidium Det er et metallisk element som tilhører gruppe 1 i det periodiske systemet: alkalimetallene, som er representert med det kjemiske symbolet Rb. Navnet høres ut som rubin, og det er fordi utslippsspektret da det ble oppdaget viste karakteristiske linjer med dyp rød farge..
Det er et av de mest reaktive metallene som finnes. Det er den første av alkalimetallene som, til tross for at de ikke er veldig tette, synker i vann. Det reagerer også med det mer eksplosivt sammenlignet med litium, natrium og kalium. Det har vært eksperimenter der blemmer sprekker der det lagres (nederste bilde) for å falle og eksplodere i badekar.

Rubidium utmerker seg ved å være et dyrere metall enn selve gullet; ikke så mye på grunn av knapphet, men på grunn av den brede mineralogiske fordelingen i jordskorpen og vanskelighetene som oppstår når den isoleres fra kalium- og cesiumforbindelser..
Det viser en klar tendens til å assosiere seg med kalium i mineralene, og blir funnet som urenheter. Ikke bare i geokjemiske forhold danner den en duo med kalium, men også innen biokjemi.
Organismen "forvirrer" K-ionene+ av de av Rb+; imidlertid er rubidium ikke et essensielt element til dags dato, da dets rolle i stoffskiftet er ukjent. Allikevel har rubidiumtilskudd blitt brukt for å lindre visse medisinske tilstander som depresjon og epilepsi. På den annen side avgir begge ionene en fiolett flamme til tennens varme.
På grunn av de høye kostnadene er applikasjonene ikke basert for mye på syntesen av katalysatorer eller materialer, men som en komponent for forskjellige enheter med teoretiske fysiske baser. En av dem er atomuret, solceller og magnetometre. Dette er grunnen til at rubidium noen ganger blir sett på som et undervurdert eller understudert metall..
Artikkelindeks
- 1 Historie
- 2 Fysiske og kjemiske egenskaper
- 2.1 Utseende
- 2.2 Atomnummer (Z)
- 2.3 Molar masse
- 2.4 Smeltepunkt
- 2.5 Kokepunkt
- 2.6 Tetthet
- 2.7 Fusjonsvarme
- 2.8 Fordampningsvarme
- 2.9 Elektronegativitet
- 2.10 Elektronisk tilhørighet
- 2.11 Ioniseringsenergier
- 2.12 Atomeradius
- 2.13 Varmeledningsevne
- 2.14 Elektrisk motstand
- 2.15 Mohs hardhet
- 2.16 Reaktivitet
- 3 Struktur og elektronisk konfigurasjon
- 3.1 oksidasjonsnumre
- 3.2 Klynger
- 4 Hvor å finne og skaffe
- 4.1 Jordskorpe
- 4.2 Geokjemisk forening
- 4.3 Fraksjonell krystallisering
- 4.4 Elektrolyse eller reduksjon
- 5 isotoper
- 6 Risiko
- 6.1 Metall
- 6,2 ioner
- 7 bruksområder
- 7.1 Gassoppsamler
- 7.2 Pyroteknikk
- 7.3 Tillegg
- 7.4 Bose-Einstein kondensat
- 7.5 Diagnose av svulster
- 7.6 Komponent
- 7.7 Atomklokker
- 8 Referanser
Historie
Rubidium ble oppdaget i 1861 av tyske kjemikere Robert Bunsen og Gustav Kirchhoff ved bruk av spektroskopi. For å gjøre dette brukte de Bunsen-brenneren og spektroskopet, oppfunnet to år tidligere, samt analytiske utfellingsteknikker. Hans studieobjekt var mineralet lepidolit, hvis prøve ble samlet fra Sachsen, Tyskland.
De startet fra 150 kg lepidolitmineral, som de behandlet med kloroplatinsyre, HtoPtCl6, å felle ut kaliumheksaklorplatinat, KtoPtCl6. Men da de studerte spektrumet ved å brenne det i Bunsen-brenneren, innså de at det viste utslippslinjer som ikke falt sammen på det tidspunktet med noe annet element..
Utslippsspekteret til dette nye elementet er preget av å ha to veldefinerte linjer i den røde regionen. Derfor døpte de den med navnet 'rubidus' som betyr 'mørkerød'. Senere klarte Bunsen og Kirchhoff å skille RbtoPtCl6 fra KtoPtCl6 ved fraksjonell krystallisering; for å endelig redusere det til kloridsaltet ved hjelp av hydrogen.
De tyske kjemikerne identifiserte og isolerte et salt av det nye elementet rubidium, og trengte bare å redusere det til metallisk tilstand. For å oppnå dette prøvde de på to måter: å bruke elektrolyse på rubidiumklorid, eller varme opp et salt som er lettere å redusere, for eksempel tartrat. Det var således at metallisk rubidium ble født.
Fysiske og kjemiske egenskaper
Utseende
Myk, sølvgrå metall. Det er så glatt at det ser ut som smør. Det er vanligvis pakket i glassampuller, hvor det hersker en inert atmosfære som beskytter den mot å reagere med luft..
Atomnummer (Z)
37
Molarmasse
85,4678 g / mol
Smeltepunkt
39 ºC
Kokepunkt
688 ºC
Tetthet
Ved romtemperatur: 1,532 g / cm3
Ved smeltepunkt: 1,46 g / cm3
Tettheten av rubidium er høyere enn for vann, så den vil synke mens den reagerer voldsomt med den.
Fusjonsvarme
2,19 kJ / mol
Fordampningsvarme
69 kJ / mol
Elektronegativitet
0,82 på Pauling-skalaen
Elektronisk tilhørighet
46,9 kJ / mol
Ioniseringsenergier
-Først: 403 kJ / mol (Rb+ gassformig)
-Andre: 2632,1 kJ / mol (Rbto+ gassformig)
-Tredje: 3859,4 kJ / mol (Rb3+ gassformig)
Atomic radio
248 pm (empirisk)
Termisk ledningsevne
58,2 W / (mK)
Elektrisk motstand
128 nΩm ved 20 ° C
Mohs hardhet
0,3. Derfor er til og med talkum vanskeligere enn metallisk rubidium..
Reaktivitet

Rubidium er et av de mest reaktive alkalimetallene etter cesium og francium. Så snart den er utsatt for luft, begynner den å brenne, og hvis den blir truffet, skyter den lette gnister. Ved oppvarming avgir den også en fiolett flamme (toppbilde), noe som er en positiv test for Rb-ioner.+.
Reagerer med oksygen for å danne en blanding av peroksider (RbtoELLERto) og superoksider (RbOto). Selv om det ikke reagerer med syrer og baser, reagerer det voldsomt med vann, og genererer rubidiumhydroksid og hydrogengass:
Rb (s) + HtoO (l) => RbOH (aq) + Hto(g)
Reagerer med hydrogen for å danne dets tilsvarende hydrid:
Rb (s) + Hto(g) => 2RbH (s)
Og også med halogener og svovel eksplosivt:
2Rb (s) + Clto(g) => RbCl (s)
2Rb (s) + S (l) => RbtoH.H)
Selv om rubidium ikke regnes som et giftig element, er det potensielt farlig og utgjør brannfare når det kommer i kontakt med vann og oksygen..
Struktur og elektronisk konfigurasjon
Rubidiumatomene er ordnet på en slik måte at de etablerer en krystall med en kroppssentrert kubisk struktur (bcc, for akronymet på engelsk body centered cubic). Denne strukturen er karakteristisk for alkalimetaller, som er lette og har en tendens til å flyte på vann; unntatt fra rubidium dun (cesium og francium).
I rubidium bcc-krystaller samhandler deres Rb-atomer med hverandre takket være metallbindingen. Dette styres av et "hav av elektroner" fra valensskallet, fra 5-tallet orbital i henhold til dets elektroniske konfigurasjon:
[Kr] 5s1
Alle 5-tallet orbitaler med deres enkeltelektron overlapper i alle dimensjoner av metalliske rubidiumkrystaller. Imidlertid er disse interaksjonene svake, fordi når en kommer ned gjennom alkalimetallgruppen, blir orbitalene mer diffuse, og derfor svekkes metallbindingen..
Det er derfor smeltepunktet for rubidium er 39 ºC. På samme måte forklarer dens svake metallbinding mykheten til det faste stoffet; så mykt at det ser ut som sølvsmør.
Det er ikke nok bibliografisk informasjon om oppførselen til krystallene under høyt trykk; hvis det er tettere faser med unike egenskaper som natrium.
Oksidasjonsnumre
Den elektroniske konfigurasjonen indikerer med en gang at rubidium sterkt har en tendens til å miste sitt enkeltelektron for å bli isoelektronisk til edelgass-krypton. Når den gjør det, dannes det monovalente kationen Rb+. Det sies da at det i dets forbindelser har oksidasjonsnummer +1 når det antas at dette kation eksisterer.
På grunn av tendensen til oksidasjon av rubidium, antas det at Rb-ioner eksisterer+ i dens forbindelser er riktig, noe som igjen indikerer den ioniske karakteren til disse forbindelsene.
I nesten alle rubidiumforbindelser har det et oksidasjonsnummer på +1. Eksempler på dem er følgende:
-Rubidiumklorid, RbCl (Rb+Cl-)
-Rubidiumhydroksid, RbOH (Rb+ Åh-)
-Rubidiumkarbonat, RbtoCO3 (Rbto+CO3to-)
-Rubidium monoxide, RbtoO (Rbto+ELLERto-)
-Rubidium superoxide, RbOto (Rb+ELLERto-)
Selv om det er veldig sjeldent, kan rubidium også ha et negativt oksidasjonsnummer: -1 (Rb-). I dette tilfellet vil vi snakke om et "rubidid" hvis det dannet en forbindelse med et element som er mindre elektronegativ enn det, eller hvis det ble utsatt for det under spesielle og strenge forhold.
Klynger
Det er forbindelser der hvert Rb-atom hver presenterer oksidasjonstall med brøkverdier. For eksempel i Rb6O (Rb6to+ELLERto-) og Rb9ELLERto (Rb94+ELLERtoto-) den positive ladningen fordeles mellom et sett med Rb-atomer (klynger). Dermed i Rb6Eller oksidasjonstallet i teorien ville være +1/3; mens du var i Rb9ELLERto, + 0,444 (4/9).
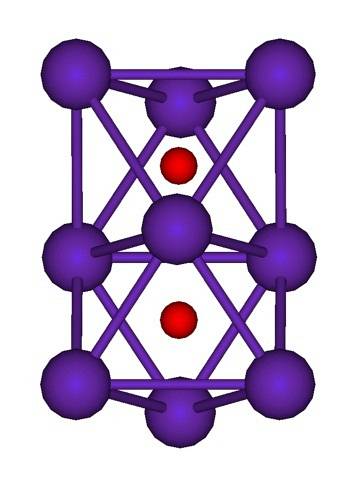
Klyngestrukturen til Rb er vist ovenfor.9ELLERto representert av en modell av kuler og stenger. Legg merke til hvordan de ni Rb-atomene "omslutter" O-anionene.to-.
I form av elukubrering er det som om en del av de originale metalliske rubidiumkrystallene forble uendret mens de ble skilt fra moderkrystallen. De mister elektroner i prosessen; de som er nødvendige for å tiltrekke seg Oto-, og den resulterende positive ladningen fordeles mellom alle atomene i nevnte klynge (sett eller aggregater av Rb-atomer).
Derfor, i disse rubidiumklyngene, kan eksistensen av Rb ikke formelt antas.+. Rb6O og Rb9ELLERto De er klassifisert som rubidiumsuboksider, der denne tilsynelatende anomali å ha et overskudd av metallatomer i forhold til oksidanionene er oppfylt.
Hvor å finne og skaffe
jordskorpe

Rubidium er det 23. mest vanlige elementet i jordskorpen, med en overflod som kan sammenlignes med metallene sink, bly, cesium og kobber. Detaljene er at ionene er vidt diffundert, så det dominerer ikke i noe mineral som det viktigste metalliske elementet, og malmene er også knappe..
Det er av denne grunn at rubidium er et veldig kostbart metall, til og med mer enn gull i seg selv, siden prosessen med å skaffe seg fra malmen er kompleks på grunn av vanskeligheter med utnyttelse..
I naturen, gitt sin reaktivitet, finnes ikke rubidium i sin opprinnelige tilstand, men som et oksid (RbtoO), klorid (RbCl) eller ledsaget av andre anioner. Dens "gratis" ioner Rb+ finnes i havene med en konsentrasjon på 125 µg / L, så vel som i varme kilder og elver.
Blant mineralene i jordskorpen som inneholder den i en konsentrasjon på mindre enn 1% har vi:
-Leucite, K [AlSitoELLER6]
-Polucita, Cs (SitoHallo6NHtoELLER
-Carnalite, KMgCl36HtoELLER
-Zinnwaldite, KLiFeAl (AlSi3)ELLER10(OH, F)to
-Amazonitt, Pb, KAlSi3ELLER8
-Petalite, LiAlSi4ELLER10
-Biotitt, K (Mg, Fe)3AlSi3ELLER10(OH, F)to
-Rubicline, (Rb, K) AlSi3ELLER8
-Lepidolite, K (Li, Al)3(Ja, Al)4ELLER10(F, OH)to
Geokjemisk forening
Alle disse mineralene deler en eller to ting til felles: de er kalium-, cesium- eller litiumsilikater, eller de er mineralsalter av disse metallene..
Dette betyr at rubidium har en sterk tendens til å assosiere seg med kalium og cesium; Det kan til og med erstatte kalium under krystalliseringen av mineraler eller bergarter, slik det skjer i avleiringer av pegmatitter når magma krystalliserer. Dermed er rubidium et biprodukt av utnyttelse og raffinering av disse bergartene og deres mineraler..
Rubidium kan også finnes i vanlige bergarter som granitt, leire og basalt, og til og med i karbonavsetninger. Av alle naturlige kilder representerer lepidolit hovedmalmen og som den utnyttes kommersielt fra..
I karnalitt kan derimot rubidium bli funnet som RbCl-urenheter med et innhold på 0,035%. Og i en høyere konsentrasjon er det avleiringer av polucitt og rubiklin, som kan ha opptil 17% rubidium..
Dens geokjemiske tilknytning til kalium skyldes likheten mellom deres ioniske radier; Rb+ er større enn K+, men størrelsesforskjellen er ikke en hindring for den første å kunne erstatte den andre i sine mineralkrystaller.
Fraksjonell krystallisering
Enten det starter med lepidolit eller polucitt, eller med noen av mineralene som er nevnt ovenfor, forblir utfordringen den samme i større eller mindre grad: skille rubidium fra kalium og cesium; det vil si anvendelse av blandingsseparasjonsteknikker som tillater å ha rubidiumforbindelser eller salter på den ene siden, og de av kalium og cesium, på den andre..
Dette er vanskelig siden disse ionene (K+, Rb+ og Cs+) har en stor kjemisk likhet; De reagerer på samme måte for å danne de samme saltene, som neppe skiller seg ut fra hverandre takket være dens tetthet og løseligheter. Det er derfor fraksjonell krystallisering brukes, slik at de kan krystallisere sakte og på en kontrollert måte..
For eksempel brukes denne teknikken til å skille en blanding av karbonater og alun fra disse metallene. Omkrystalliseringsprosessene må gjentas flere ganger for å garantere krystaller med større renhet og fri for co-utfelte ioner; et rubidiumsalt som krystalliserer med K-ioner+ eller Cs+ på overflaten eller på innsiden.
Mer moderne teknikker, som bruk av en ionebytterharpiks, eller kronetere som kompleksdannende midler, tillater også isolering av Rb-ioner.+.
Elektrolyse eller reduksjon
Når rubidiumsaltet er separert og renset, er neste og siste trinn å redusere Rb-kationene+ til solid metall. For å gjøre dette blir saltet smeltet og utsatt for elektrolyse slik at rubidium faller ut på katoden; eller det brukes et sterkt reduksjonsmiddel, slik som kalsium og natrium, som er i stand til raskt å miste elektroner og dermed redusere rubidium.
Isotoper
Rubidium finnes på jorden som to naturlige isotoper: 85Rb og 87Rb. Den første har en overflod på 72,17%, mens den andre har 27,83%.
De 87Rb er ansvarlig for at dette metallet er radioaktivt; strålingen er imidlertid ufarlig og til og med gunstig for dataanalyse. Halveringstiden (t1/2) er 4,91010 år, hvis tidsrom overstiger universets alder. Når den forfaller, blir den den stabile isotopen 87MR.
Takket være dette har denne isotopen blitt brukt til å datere alderen til jordiske mineraler og bergarter som var til stede siden begynnelsen av jorden..
I tillegg til isotoper 85Rb og 87Rb, det er andre syntetiske og radioaktive med variabel og mye kortere levetid; For eksempel ham 82Rb (t1/2= 76 sekunder), 83Rb (t1/2= 86,2 dager), 84Rb (t1/2= 32,9 dager) og 86Rb (t1/2= 18,7 dager). Av alle, 82Rb er den mest brukte i medisinske studier.
Risiko
Metall
Rubidium er et så reaktivt metall at det må lagres i glassampuller under en inert atmosfære slik at det ikke reagerer med oksygen i luften. Hvis blæren går i stykker, kan metallet plasseres i parafin eller mineralolje for å beskytte den. det vil imidlertid ende opp med å bli oksidert av oksygenet som er oppløst i dem, og føre til rubidiumperoksider.
Hvis det tvert imot blir bestemt å plassere det på tre, vil det ende opp med å brenne med en fiolett flamme. Hvis det er mye fuktighet, vil den brenne bare ved å bli utsatt for luften. Når en stor bit rubidium kastes i et volum vann, eksploderer den kraftig og til og med antenner den produserte hydrogengassen.
Derfor er rubidium et metall som ikke alle skal håndtere, siden praktisk talt alle reaksjonene er eksplosive..
Ion
I motsetning til metallisk rubidium, er dets Rb-ioner+ de representerer ikke noen tilsynelatende risiko for levende vesener. Disse oppløst i vann samhandler med celler på samme måte som K-ioner gjør.+.
Derfor har rubidium og kalium lignende biokjemiske atferd; imidlertid er ikke rubidium et essensielt element, mens kalium er det. På denne måten merkbare mengder Rb+ kan akkumuleres i celler, røde blodlegemer og innvoller uten å påvirke kroppen til noe dyr negativt.
Det er faktisk anslått at en voksen hann med en masse på 80 kg inneholder ca. 37 mg rubidium; og at i tillegg en økning i denne konsentrasjonen i størrelsesorden 50 til 100 ganger ikke fører til uønskede symptomer.
Imidlertid et overskudd av Rb-ioner+ kan ende opp med å forskyve K-ionene+; og følgelig vil individet lide veldig sterke muskelspasmer inntil døden.
Åpenbart kan løselige rubidiumsalter eller forbindelser utløse dette umiddelbart, så ingen av dem skal inntas. I tillegg kan det forårsake forbrenning ved enkel kontakt, og blant de mest giftige kan vi nevne fluor (RbF), hydroksid (RbOH) og cyanid (RbCN) av rubidium.
applikasjoner
Gassoppsamler
Rubidium har blitt brukt til å fange opp eller fjerne spor av gasser som kan være i vakuumforseglede rør. Nettopp på grunn av deres høye tendens til å fange oksygen og fuktighet i dem, eliminerer de dem på overflaten som peroksider.
Pyroteknikk
Når rubidiumsalter brenner, avgir de en karakteristisk rød-fiolett flamme. Noen fyrverkeri har disse saltene i sammensetningen slik at de eksploderer med disse fargene.
Tillegg
Rubidiumklorid er foreskrevet for å bekjempe depresjon, da studier har bestemt en mangel på dette elementet hos personer som lider av denne medisinske tilstanden. Det har også blitt brukt som beroligende middel og til å behandle epilepsi.
Bose-Einstein kondensat
Isotopatomer 87Rb ble brukt til å lage det første Bose-Einstein-kondensatet. Denne tilstanden av materie består i at atomene ved en temperatur som er ganske nær absolutt null (0 K), er gruppert eller "kondensert", og oppfører seg som om de var ett..
Dermed var rubidium hovedpersonen til denne triumfen innen fysikk, og det var Eric Cornell, Carl Wieman og Wolfgang Ketterle som mottok Nobelprisen i 2001 takket være dette arbeidet..
Svulstdiagnose
Den syntetiske radioisotopen 82Rb forfaller ved å avgi positroner, som brukes til å akkumulere i kaliumrike vev; slik som de som ligger i hjernen eller hjertet. Den brukes således til å analysere hjertets funksjonalitet og tilstedeværelsen av mulige svulster i hjernen ved hjelp av en positronemisjonstomografi..
Komponent
Rubidiumioner har funnet et sted i forskjellige typer materialer eller blandinger. For eksempel er legeringene hans laget av gull, cesium, kvikksølv, natrium og kalium. Det er tilsatt glass og keramikk, sannsynligvis for å øke smeltepunktet.
I solceller er perovskitter blitt tilsatt som en viktig komponent. Likeledes er dets mulige bruk som en termoelektrisk generator, varmeoverføringsmateriale i rommet, drivstoff i ionedrivmotorer, elektrolytisk medium for alkaliske batterier og i atomiske magnetometre også blitt studert..
Atomiske klokker
Med rubidium og cesium er de berømte, meget nøyaktige atomurene produsert, for eksempel brukt i GPS-satellitter som eierne av smarttelefonene deres kan vite hvor de beveger seg.
Referanser
- Bond Tom. (29. oktober 2008). Rubidium. Gjenopprettet fra: chemistryworld.com
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Rubidium. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. (2019). Rubidium. PubChem-database. CID = 5357696. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Chellan, P., & Sadler, P. J. (2015). Elementene i livet og medisiner. Filosofiske transaksjoner. Serie A, matematikk, fysikk og ingeniørfag, 373 (2037), 20140182. doi: 10.1098 / rsta.2014.0182
- Mayo Foundation for Medical Education and Research. (2019). Rubidium Rb 82 (intravenøs rute). Gjenopprettet fra: mayoclinic.org
- Marques Miguel. (s.f.). Rubidium. Gjenopprettet fra: nautilus.fis.uc.pt
- James L. Dye. (12. april 2019). Rubidium. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- Dr. Doug Stewart. (2019). Fakta om Rubidium Element. Chemicool. Gjenopprettet fra: chemicool.com
- Michael Pilgaard. (10. mai 2017). Rubidium kjemiske reaksjoner. Gjenopprettet fra: pilgaardelements.com


Ingen har kommentert denne artikkelen ennå.