
Selen historie, egenskaper, struktur, innhenting, bruksområder
De selen Det er et ikke-metallisk kjemisk element som tilhører gruppe 16 i det periodiske systemet og er representert med symbolet Se. Dette elementet har mellomegenskaper mellom svovel og tellur, som er medlemmer av samme gruppe.
Selen ble oppdaget i 1817 av Jöhs J. Berzelius og John G. Gahn, som da pyritten fordampet, observerte en rød rest (lavere bilde). Først forvekslet de det med tellur, men så innså de at de hadde å gjøre med et nytt element.

Berzelius kalte det nye elementet selen, basert på navnet "selene" som betyr "gudinne av månen." Selen er et viktig sporstoff for planter og dyr, men i høye konsentrasjoner er det et giftig element.
Selen har tre viktigste allotropiske former: rød, svart og grå. Sistnevnte har den egenskapen å endre sin elektriske ledning avhengig av intensiteten til lyset som utstråler det (fotoleder), som det har hatt mange applikasjoner for..
Selen distribueres mye i jordskorpen, men mineralene som inneholder den er ikke rikelig, så det er ingen gruvedrift av selen.
Det oppnås hovedsakelig som et biprodukt av raffineringsprosessen for kobberelektrolyse. Selen akkumuleres i siltet som finnes ved anoden til elektrolyseceller.
Mennesker har rundt 25 selenoproteiner, hvorav noen har en antioksidant virkning og kontrollerer genereringen av frie radikaler. Det er også aminosyrer av selen, slik som selenometionin og selenocystein.
Artikkelindeks
- 1 Historie
- 1.1 Første observasjon
- 1.2 Oppdagelse
- 1.3 Opprinnelse til navnet hans
- 1.4 Utvikle applikasjonene dine
- 2 Fysiske og kjemiske egenskaper
- 2.1 Utseende
- 2.2 Standard atomvekt
- 2.3 Atomnummer (Z)
- 2.4 Smeltepunkt
- 2.5 Kokepunkt
- 2.6 Tetthet
- 2.7 Fusjonsvarme
- 2.8 Fordampningsvarme
- 2,9 Molar varmekapasitet
- 2.10 oksidasjonsnumre
- 2.11 Elektronegativitet
- 2.12 Ioniseringsenergi
- 2.13 Magnetisk rekkefølge
- 2.14 Hardhet
- 2.15 Isotoper
- 2.16 Allotropi
- 3 Reaktivitet
- 3.1 Reaksjon med hydrogen
- 3.2 Reaksjon med oksygen
- 3.3 Reaksjon med halogener
- 3.4 Reaksjon med metaller
- 3,5 selenitter
- 3.6 Syrer
- 4 Struktur og elektronisk konfigurasjon
- 4.1 - Selen og dets obligasjoner
- 4.2 - Ringer eller kjeder
- 4.3 - Allotropes
- 5 Hvor å finne og produsere
- 5.1 Elektrolyse av kobber
- 6 Biologisk rolle
- 6.1 Mangel
- 6.2 Enzymkofaktor
- 6.3 Proteiner og aminosyrer
- 7 Risiko
- 8 bruksområder
- 8.1 Kosmetikk
- 8.2 Leger
- 8.3 Elektrolyse av mangan
- 8.4 Pigment
- 8.5 Fotoleder
- 8.6 Krystaller
- 8.7 Vulkanisering
- 8.8 Legeringer
- 8.9 likerettere
- 9 Referanser
Historie
Første observasjon
Alkymisten Arnold de Villanova kan ha observert selen i 1230. Han trente i medisin ved Sorbonne i Paris, og var til og med lege til pave Klemens V..
Villanova i boka si Rosarium Philosophorum beskriver et rødt svovel eller "sulfur rebeum" som hadde blitt igjen i en ovn etter fordamping av svovelet. Dette røde svovelet kan ha vært en allotrop av selen.
Oppdagelse
I 1817 oppdaget Jöhs Jakob Berzelius og John Gottlieb Gahn selen i et kjemisk anlegg for produksjon av svovelsyre, nær Gripsholm, Sverige. Råmaterialet for å lage syren var pyritt, som ble ekstrahert fra en Falun-gruve..
Berzelius ble rammet av eksistensen av en rød rest som var igjen i blybeholderen etter at svovelet var brent.
Berzelius og Gahn observerte også at den røde resten hadde en sterk pepperrotlukt, som ligner på tellur. Derfor skrev han til vennen Marect at de trodde at det observerte forekomsten var en tellurforbindelse..
Imidlertid fortsatte Berselius med å analysere materialet som ble avsatt da pyritten ble brent og revurdert at det ikke var funnet tellur i Falun-gruven. Han konkluderte i februar 1818 med at han hadde oppdaget et nytt element.
Navnets opprinnelse
Berzelius påpekte at det nye elementet var en kombinasjon av svovel og tellur, og at likheten mellom tellur og det nye elementet hadde gitt ham muligheten til å kalle det nye stoffet selen..
Berzelius forklarte at "tellus" betyr jordgudinne. Martin Klaport i 1799 ga dette navnet til tellurium og skrev: “Det heter ikke noe enkelt element. Det måtte gjøres! ".
På grunn av likheten mellom tellur og det nye stoffet, kalte Berzelius det med ordet selen, avledet av det greske ordet "selene" som betyr "gudinne av månen.".
Utvikling av applikasjonene dine
I 1873 oppdaget Willoughby Smith at den elektriske ledningsevnen til selen var avhengig av lyset som utstrålte det. Denne egenskapen tillot selen å ha mange applikasjoner.
Alexander Graham Bell i 1979 brukte selen i fotofonen sin. Selen produserer en elektrisk strøm proporsjonal med intensiteten til lyset som lyser opp, og brukes i lysmålere, sikkerhetsmekanismer for å åpne og lukke dører, etc..
Bruken av selen likerettere i elektronikk begynte på 1930-tallet, med mange kommersielle applikasjoner. På 1970-tallet ble den fortrengt i likerettere av silisium.
I 1957 ble det oppdaget at selen var et viktig element for pattedyrs liv, siden det var tilstede i enzymer som beskytter mot reaktivt oksygen og frie radikaler. I tillegg ble eksistensen av aminosyrer som selenometionin oppdaget.
Fysiske og kjemiske egenskaper
Utseende
Siden det er flere allotroper for selen, varierer det fysiske utseendet. Opptrer vanligvis som et rødaktig fast stoff i pulverform.
Standard atomvekt
78,971 u
Atomnummer (Z)
3. 4
Smeltepunkt
221 ºC
Kokepunkt
685 ºC
Tetthet
Tettheten av selen varierer avhengig av hvilken allotrope eller polymorf som anses. Noen av dens tettheter bestemt ved romtemperatur er:
Grå: 4,819 g / cm3
Alfa: 4,39 g / cm3
Glasslegemet: 4,28 g / cm3
Flytende tilstand (smeltepunkt): 3,99 g / cm3
Fusjonsvarme
Grå: 6,69 kJ / mol
Fordampningsvarme
95,48 kJ / mol
Molar varmekapasitet
25.363 J / (mol K)
Oksidasjonsnumre
Selen kan binde seg i forbindelsene som manifesterer følgende tall eller oksidasjonstilstander: -2, -1, +1, +2, +3, +4, +5, +6. Blant alle er de viktigste -2 (Seto-), +4 (Se4+) og +6 (Se6+).
For eksempel i SeOto selen har et oksidasjonsnummer på +4; det vil si at eksistensen av kationen Se antas4+ (Jeg vet4+ELLERtoto-). Tilsvarende med SeO3 selen har et oksidasjonsnummer på +6 (Se6+ELLER3to-).
I hydrogenselenid, HtoSe, selen har et oksidasjonsnummer på -2; det er, igjen, antas eksistensen av ionet eller anionet Seto- (Hto+Jeg vetto-). Dette skyldes at selen er mer elektronegativ enn hydrogen..
Elektronegativitet
2,55 på Pauling-skalaen.
Ioniseringsenergi
-Først: 941 kJ / mol.
-Andre: 2.045 kJ / mol.
-Tredje: 2.973,7 kJ / mol.
Magnetisk rekkefølge
Diamagnetisk.
Hardhet
2.0 på Mohs-skalaen.
Isotoper
Det er fem naturlige og stabile isotoper av selen, som er vist nedenfor med deres respektive overflod:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Allotropi

Selen fremstilt i kjemiske reaksjoner er et mursteinrødt amorft pulver, som når det raskt smelter gir opphav til glasslegemet, som ligner på rosenkransperler (toppbilde). Black Selenium er et sprøtt og blankt fast stoff.
Dessuten er svart selen lett løselig i karbonsulfid. Når denne løsningen oppvarmes til 180 ºC, faller grå selen ut, den er mest stabile og tette allotropen..
Grå selen er motstandsdyktig mot oksidasjon og er inert mot virkningen av ikke-oksiderende syrer. Hovedegenskapen til dette selen er fotoledningsevnen. Når den er opplyst, øker den elektriske ledningsevnen med en faktor på 10 til 15 ganger.
Reaktivitet
Selen i dets forbindelser eksisterer i oksidasjonstilstandene -2, +4 og +6. Det viser en klar tendens til å danne syrer i høyere oksidasjonstilstander. Forbindelser som har selen med oksidasjonstilstand -2 kalles selenider (Seto-).
Reaksjon med hydrogen
Selen reagerer med hydrogen og danner hydrogenselenid (HtoSe), en fargeløs, brennbar og illaluktende gass.
Reaksjon med oksygen
Selen brenner og avgir en blå flamme og danner selendioksid:
Jeg vet8 (s) + 8 Oto => 8 SeOto (s)
Selenoksid er et fast, hvitt, polymert stoff. Dens hydrering produserer selenious syre (HtoSeO3). Også selen danner selentrioksid (SeO3), analog med svovel (SO3).
Reaksjon med halogener
Selen reagerer med fluor og danner selenheksafluorid:
Jeg vet8 (s) + 24 F.to (g) => 8 SeF6 (l)
Selen reagerer med klor og brom for å danne henholdsvis disileniumdiklorid og dibromid:
Jeg vet8 (s) + 4 Clto => 4 SetoClto
Jeg vet8 (s) + 4 Brto => 4 SetoBrto
Selen kan også danne SeF4 og SeCl4.
På den annen side danner selen forbindelser der et selenatom forbinder med ett av halogen og et annet av oksygen. Et viktig eksempel er selenoksyklorid (SeOtoClto), med selen i oksidasjonstilstand +6, et ekstremt kraftig løsemiddel.
Reaksjon med metaller
Selen reagerer med metaller for å danne selenider av aluminium, kadmium og natrium. Den kjemiske ligningen nedenfor tilsvarer den for dannelsen av aluminiumselenid:
3 Se8 + 16 Al => 8 AltoJeg vet3
Selenitter
Selen danner salter kjent som selenitter; for eksempel: sølv selenitt (AgtoSeO3) og natriumselenitt (NatoSeO3). Dette navnet har blitt brukt i en litterær sammenheng for å referere til innbyggerne på månen: Selenittene.
Syrer
Den viktigste syren i selen er seleninsyre (HtoSeO4). Den er like sterk som svovelsyre og reduseres lettere.
Struktur og elektronisk konfigurasjon
- Selen og dens lenker
Selen har seks valenselektroner, og det er derfor det ligger i gruppe 16, det samme som oksygen og svovel. Disse seks elektronene er i 4s og 4p orbitaler, i henhold til deres elektroniske konfigurasjon:
[Ar] 3d10 4sto 4p4
Det trenger derfor, som svovel, å danne to kovalente bindinger for å fullføre valensoktet; selv om den har tilgjengeligheten av sine 4d-orbitaler til å binde seg med mer enn to atomer. Dermed kommer tre selenatomer sammen og danner to kovalente bindinger: Se-Se-Se.
Selen med sin høyeste atommasse har en naturlig tendens til å danne strukturer styrt av kovalente bindinger; i stedet for å bli ordnet som diatomiske molekyler Seto, Se = Se, analogt med Oto, O = O.
- Ringer eller kjeder
Blant de molekylære strukturene som selenatomer bruker, kan to nevnes generelt: ringer eller kjeder. Legg merke til at i det hypotetiske tilfellet Se3, Se-atomene i endene krever fortsatt elektroner; derfor må de være bundet til andre atomer, etter hverandre, til kjeden kan lukkes i en ring.
De vanligste ringene er åtteleddede ringer eller atomer av selen:8 (en selenittkrone). Hvorfor åtte? Fordi jo mindre ringen er, desto mer stress vil den lide; det vil si at vinklene på deres obligasjoner avviker fra de naturlige verdiene satt av deres hybridiseringer3 (lignende som forekommer med cykloalkaner).
Siden det er åtte atomer, er separasjonen mellom Se-Se-atomene tilstrekkelig slik at bindingen deres blir "avslappet" og ikke "bøyd"; selv om vinkelen på lenkene er 105,7 º og ikke 109,5 º. På den annen side kan det være mindre ringer:6 og7.
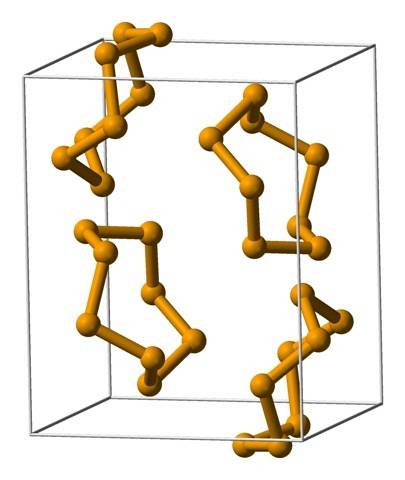
Det øverste bildet viser Se ring-enhetene.8. Legg merke til likheten de har med svovelkronene; bare de er større og tyngre.
I tillegg til ringer, kan selenatomer også ordnes i spiralformede kjeder (tenk spiraltrapper):
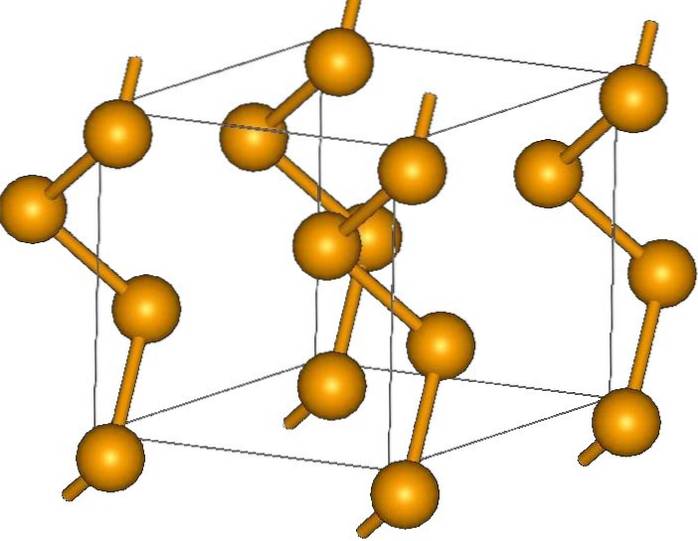
I endene kan det være terminale dobbeltbindinger (-Se = Se), eller Se-ringer8.
- Allotropes
Når man tar i betraktning at det kan være spiralformede ringer eller kjeder av selen, og at deres dimensjoner også kan variere avhengig av antall atomer de inneholder, så er det tydelig at det er mer enn en allotrop for dette elementet; det vil si rene faste selenstoffer, men med forskjellige molekylære strukturer.
Rødt selen
Blant de mest fremtredende allotropene av selen har vi rødt, som kan fremstå som et amorft pulver, eller som monokliniske og polymorfe krystaller (se bilde av Se8).
I amorft rødt selen er strukturene uordnede uten tilsynelatende mønstre; mens ringene etablerer en monoklinisk struktur i linsen. Rødt krystallinsk selen er polymorf og har tre faser: α, β og γ, som avviker i tetthet..
Svart selen
Strukturen til svart selen består også av ringer; men ikke av åtte medlemmer, men av mange flere, som når opp til ringer på tusen atomer (Se1000). Det sies da at strukturen er kompleks og består av polymere ringer; noen større eller mindre enn andre.
Siden det er polymerringer av forskjellige størrelser, er det vanskelig å forvente at de etablerer en strukturell orden; så det sorte selenet er også amorft, men i motsetning til det rødlige pulveret som er nevnt ovenfor, har det glassete teksturer, selv om det er sprøtt.
Grå selen
Og til slutt, av de enkleste allotropene av selen er grå, som skiller seg ut over de andre, da den er den mest stabile under normale forhold, og har også et metallisk utseende..
Krystallene kan være sekskantede eller trigonale, etablert av spredningskreftene i London mellom dets polymere spiralformede kjeder (øvre bilde). Vinkelen på deres bindinger er 130,1 º, noe som indikerer et positivt avvik fra de tetraedriske omgivelsene (med vinkler på 109,5 º)..
Derfor gir selen spiralformede kjeder inntrykk av å være "åpne". I form av elukubrering, i denne strukturen vender atomene mot hverandre, så i teorien må det være en større overlapping av deres orbitaler for å skape ledningsbånd.
Varmen med økningen av molekylære vibrasjoner skader disse båndene når kjedene blir uordnede. mens energien til et foton påvirker elektronene direkte, spennende dem og markedsfører deres transaksjoner. Fra dette synspunktet er det "enkelt" å forestille seg fotoledningsevnen for grått selen..
Hvor den ligger og produksjon
Selv om det er mye distribuert, er selen et sjeldent element. Det finnes i sin opprinnelige tilstand assosiert med svovel og mineraler som eukairitt (CuAgSe), klaustalitt (PbSe), naumanitt (AgtoSe), og krokosittsted [(CuTiAg)toJeg vet].
Selen er funnet som en urenhet som erstatter svovel i en liten del av svovelholdige mineraler av metaller; som kobber, bly, sølv osv..
Det er jordsmonn der selen eksisterer i løselig form av selenater. Disse blir båret av regnvannet til elvene og derfra til havet.
Noen planter er i stand til å absorbere og konsentrere selen. For eksempel inneholder en kopp paranøtter 544 µg selen, en mengde som tilsvarer 777% av den daglige anbefalte mengden selen..
Hos levende vesener finnes selen i noen aminosyrer, slik som: selenometionin, selenocystein og metylselenocystein. Selenocystein og selenitt reduseres til hydrogenselenid.
Elektrolyse av kobber
Det er ingen gruvedrift av selen. Det meste av det oppnås som et biprodukt av kobberelektrolyseraffineringsprosessen, og blir funnet i siltet som akkumuleres ved anoden..
Det første trinnet er produksjonen av selen dioksid. For dette behandles anodisk silt med natriumkarbonat for å produsere oksidasjonen. Deretter tilsettes vann til selenoksid, og det surgjøres for å danne selen..
Til slutt behandles selensyre med svoveldioksid for å redusere den og oppnå elementært selen..
I en annen metode i blandingen av silt og slam dannet i produksjonen av svovelsyre, oppnås et urent rødt selen som oppløses i svovelsyre..
Selensyre og selensyre dannes deretter. Denne selen syren får samme behandling som den forrige metoden.
Klor, som virker på metallselenider, kan også brukes til å produsere flyktige klorerte selenforbindelser; slik som: SetoClto, SeCl4, SeClto og SeOClto.
Disse forbindelsene omdannes i en prosess utført i vann til selenious syre, som blir behandlet med svoveldioksid for å frigjøre selen..
Biologisk rolle
Mangel
Selen er et viktig sporstoff for planter og dyr, hvis mangel på mennesker har forårsaket alvorlige lidelser som Keshans sykdom; en sykdom preget av skade på hjerteinfarkt.
I tillegg er selenmangel assosiert med infertilitet hos menn og kan spille en rolle i Kashin-Beck sykdom, en type slitasjegikt. Selenmangel er også observert ved revmatoid artritt.
Enzymkofaktor
Selen er en komponent av enzymer med antioksidantvirkning, slik som glutationperoksidase og tioredoksinreduktase som virker for å eliminere stoffer med reaktivt oksygen..
I tillegg er selen en kofaktor av skjoldbruskhormon deiodinaser. Disse enzymene er viktige for å regulere funksjonen til skjoldbruskhormoner..
Bruk av selen er rapportert i behandlingen av Hasimotos sykdom, en autoimmun sykdom med dannelse av antistoffer mot skjoldbruskkjertelceller.
Selen har også blitt brukt for å redusere de toksiske effektene av kvikksølv, da noen av dets handlinger utøves på selenavhengige antioksidante enzymer.
Proteiner og aminosyrer
Mennesket har omtrent 25 selenoproteiner som utøver en antioksidantvirkning for beskyttelse mot oksidativt stress, initiert av et overskudd av reaktive oksygenarter (ROS) og reaktive nitrogenarter (NOS)..
Tilstedeværelsen av aminosyrene selenometiocin og selenocystein er blitt påvist hos mennesker. Selenometionin brukes som kosttilskudd i behandlingen av selenmangeltilstander.
Risiko
En høy kroppskonsentrasjon av selen kan ha en rekke skadelige effekter på helsen, fra og med sprøtt hår og sprø negler, mot hudutslett, varme, ødem i huden og alvorlig smerte.
Når du behandler selen i kontakt med øynene, kan folk oppleve svie, irritasjon og rive. I mellomtiden kan langvarig eksponering for røyk med høyt selen forårsake lungeødem, hvitløkspust og bronkitt..
I tillegg kan personen oppleve lungebetennelse, kvalme, frysninger, feber, ondt i halsen, diaré og hepatomegali..
Selen kan samhandle med andre medisiner og kosttilskudd, som antacida, antineoplastiske legemidler, kortikosteroider, niacin og p-piller..
Selen har vært assosiert med økt risiko for hudkreft. En studie fra National Cancer Institute fant at menn med høyt seleninnhold var dobbelt så sannsynlig å lide av aggressiv prostatakreft.
En studie indikerer at det daglige inntaket av 200 µg selen øker muligheten for å utvikle type II diabetes med 50%.
applikasjoner
Kosmetikk
Selen sulfid brukes til behandling av seborrhea, så vel som fett eller flasshår.
Leger
Det brukes som en alternativ medisin i behandlingen av Hasimotos sykdom, en autoimmun sykdom i skjoldbruskkjertelen.
Selen reduserer toksisiteten til kvikksølv, en av dets giftige aktiviteter utøves på avoksiderende enzymer, som bruker selen som en kofaktor.
Mangan elektrolyse
Bruk av selenoksid i elektrolyse av mangan reduserer kostnadene ved teknikken betydelig, siden det reduserer strømforbruket.
Pigment
Selen brukes som pigment i maling, plast, keramikk og glass. Avhengig av selen som brukes, varierer fargen på glasset fra dyp rød til lys oransje..
Fotoledende
På grunn av egenskapen til grått selen for å endre dets elektriske ledningsevne som en funksjon av lysintensiteten som utstråler det, har selen blitt brukt i kopimaskiner, fotoceller, fotometre og solceller.
Bruken av selen i kopimaskiner var en av de viktigste anvendelsene av selen; men utseendet til organiske fotoledere har redusert bruken av dem.
Krystaller
Selen brukes til misfarging av briller, som et resultat av tilstedeværelsen av jern som gir en grønn eller gul farge. I tillegg tillater det en rød farging av glasset, avhengig av bruken du vil gi det..
Vulkanisering
Diethyldithiocarbonate selen brukes som et vulkaniserende middel i gummiprodukter.
Legeringer
Selen brukes i kombinasjon med vismut i messing for å erstatte bly; Svært giftig element som har redusert bruken på grunn av anbefalingene fra helseorganisasjoner.
Selen tilsettes i lave konsentrasjoner til stål og kobberlegeringer for å forbedre bruken av disse metallene..
Likerettere
Selen-likerettere begynte å bli brukt i 1933 til 1970-tallet, da de ble erstattet av silisium på grunn av lave kostnader og overlegen kvalitet..
Referanser
- Royal Australian Chemical Institute. (2011). Selen. [PDF]. Gjenopprettet fra: raci.org.au
- Wikipedia. (2019). Selen. Gjenopprettet fra: en.wikipedia.org
- Sato Kentaro. (s.f.). Nye Allotropes av hovedgruppeelementer. [PDF]. Gjenopprettet fra: tcichemicals.com
- Dr. Dough Stewart. (2019). Fakta om selen. Chemicool. Gjenopprettet fra: chemicool.com
- Robert C. Brasted. (28. august 2019). Selen. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- Marques Miguel. (s.f.). Selen. Gjenopprettet fra: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (3. juli 2019). Selen fakta. Gjenopprettet fra: thoughtco.com
- Lenntech B. V. (2019). Periodisk system: selen. Gjenopprettet fra: lenntech.com
- Tinggi U. (2008). Selen: dens rolle som antioksidant i menneskers helse. Miljøhelse og forebyggende medisin, 1. 3(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Kontor for kosttilskudd. (9. juli 2019). Selen: Faktaark for helsepersonell. National Institute of Health. Gjenopprettet fra: ods.od.nih.gov


Ingen har kommentert denne artikkelen ennå.